
【题目】砷(As)可作为半导体村料锗(Ge)和硅的掺杂元素,这些材料广泛应用于发光二极管、红外线发射器等。回答下列问题:
(1)天然的SiO2存在形态有结晶形和无定形两大类,结晶形SiO2能自发的呈现规则多面体外形的性质被称为晶体的______________性,区分这两种形态的SiO2最可靠的方法足对固体进行___________实验。
(2)基态砷原子的价层电子排布图为_____________,最高能层符号为_____________,Ge、As、Se第一电离能从大到小的顺序为_____________________。
(3)锗元素与碳元素类似,可形成锗烷(GenH2n+2),但至今没有发现n大于5的锗烷,根据下表提供的数据分析其中的原因_____________________。
化学键 | C-C | C-H | Ge-Ge | Ge-H |
键能(kJ·mol-1) | 346 | 411 | 188 | 288 |
(4) GeCl4分子中的键角为_____________,GeH4分子中Ge的_____________轨道和H的_________轨道重叠形成σ键。
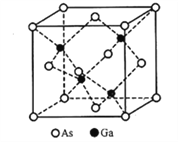
(5)立方砷化镓的晶胞如下图所示,已知晶胞边长为565pm,则Ga-As键的键长为___________pm(只列出算式即可),Ga-As键中共用电子对偏向____________(填“Ga”或“As”)。
【答案】 自范 X-射线衍射 ![]() N As>Se>Ge 锗烷中“Ge-Ge”键和“Ge-H”键键能较小,易断裂,导致长链锗烷难以形成( 109028' sP3杂化 1s
N As>Se>Ge 锗烷中“Ge-Ge”键和“Ge-H”键键能较小,易断裂,导致长链锗烷难以形成( 109028' sP3杂化 1s ![]() ×565 As
×565 As
【解析】试题分析:试题以半导体材料为载体,主要考查晶体的自范性、晶体与非晶体区分方法、电子排布、第一电离能、键能与分子稳定性关系、杂化、σ键形成、电负性、晶体的简单计算等知识,考查考生对物质结构知识的综合运用能力和晶体的简单计算能力。
解析:(1)晶体能自发呈现规则多面体外形的性质称作晶体的自范性。区分晶体与非晶体的最可靠的方法是X-射线衍射。正确答案:自范、X-射线衍射。(2)砷为33号元素,核外电子排布式为1s22s22p63s23p63d104s24p3,价电子排布为4s24p3,所以价电子排布图为![]() ,最高能层为第四层,能层符号是N,As位于元素周期表第四周期ⅤA,Ge为32号元素,位于元素周期表第四周期ⅣA,Se为34号元素,位于元素周期表第四周期ⅥA,同一周期从左到右各元素第一电离能呈增大的趋势,但是处于全满和半满是一种亚稳定状态,第一电离能比相邻的元素高,所以它们的第一电离能大小顺序为As>Se>Ge。正确答案:
,最高能层为第四层,能层符号是N,As位于元素周期表第四周期ⅤA,Ge为32号元素,位于元素周期表第四周期ⅣA,Se为34号元素,位于元素周期表第四周期ⅥA,同一周期从左到右各元素第一电离能呈增大的趋势,但是处于全满和半满是一种亚稳定状态,第一电离能比相邻的元素高,所以它们的第一电离能大小顺序为As>Se>Ge。正确答案:![]() 、N、As>Se>Ge。(3)由表格数据可知,C—C键的键能远大于Ge—Ge键,C—H键的键能远大于Ge—H键,因此锗烷中Ge—Ge键、Ge—H键都容易发生断裂。正确答案:锗烷中Ge-Ge键和Ge-H键键能较小,易断裂,导致长链锗烷难以形成。(4)GeCl4、GeH4分子中心原子Ge都是采用sp3杂化,所以GeCl4分子中键角为109028'。GeH4分子中,Ge原子使用sp3杂化轨道分别与H原子的1s轨道重叠形成σ键。正确答案:109028'、sp3杂化、1s。(5)立方砷化镓晶胞中,As位于立方体的顶点和面心的位置,Ga位于立方体对角线距离顶点1/4处,立方体对角线长
、N、As>Se>Ge。(3)由表格数据可知,C—C键的键能远大于Ge—Ge键,C—H键的键能远大于Ge—H键,因此锗烷中Ge—Ge键、Ge—H键都容易发生断裂。正确答案:锗烷中Ge-Ge键和Ge-H键键能较小,易断裂,导致长链锗烷难以形成。(4)GeCl4、GeH4分子中心原子Ge都是采用sp3杂化,所以GeCl4分子中键角为109028'。GeH4分子中,Ge原子使用sp3杂化轨道分别与H原子的1s轨道重叠形成σ键。正确答案:109028'、sp3杂化、1s。(5)立方砷化镓晶胞中,As位于立方体的顶点和面心的位置,Ga位于立方体对角线距离顶点1/4处,立方体对角线长![]() ,则Ga—As键键长
,则Ga—As键键长![]() 。Ga和As同处于第四周期,原子序数相对较小的Ga位于左侧,电负性较小,所以Ga—As键中共用电子对偏向电负性较大大As。正确答案:
。Ga和As同处于第四周期,原子序数相对较小的Ga位于左侧,电负性较小,所以Ga—As键中共用电子对偏向电负性较大大As。正确答案:![]() 、As。
、As。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】己知:I2+2S2O32-=S4O62-+2I-。相关物质的溶度积常数见下表:
物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
Ksp | 2.2×10-20 | 2.6×l0-39 | 1.7×l0-7 | 1.3×l0-12 |
(1)某酸性CuCl2溶液中含有少量的FeCl3,为得到纯净的CuC12·2H2O晶体,常加入CuO或Cu(OH)2,调至pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=_____________。 过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2·2H2O晶体。
(2)在空气中直接加热CuCl2·2H2O晶体得不到纯的无水CuC12, 原因是(用化学方程式表示)_____________________________,由CuCl2·2H2O晶体得到纯净的无水CuCl2的合理方法是________________________________________________。
(3)某学习小组用“间接碘量法”测定含有CuCl2·2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取1.44g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀(CuI)。将反应后的溶液稀释为100 mL,用0.1000mol/LNa2S2O3标准溶液(溶液呈弱碱性)进行滴定,滴定结果如下表所示。
滴定次数 | 待测溶液的体积/mL | 标准溶液的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
1 | 25.00 | 0.02 | 22.03 |
2 | 25.00 | 2.00 | 21.98 |
3 | 25.00 | 0.20 | 20.22 |
①可选用__________作滴定指示剂,滴定终点的现象是_________________________。
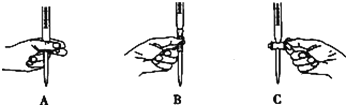
②滴定过程中操作滴定管的图示正确的是_____________。
③若滴定时出现下列情况,测定结果偏高的是___________。
a.滴定前用蒸馏水冲洗锥形瓶 b.滴定前滴定管尖嘴有气泡,滴定后气泡消失
c.酸式滴定管滴至终点时俯视读数 d.酸式滴定管用蒸水洗后,未用标准液润洗
④CuCl2溶液与KI反应的离子方程式为______________________________。
⑤该试样中CuCl2·2H2O的质量百分数为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】安全是顺利进行实验及避免伤害的保障.下列实验操作正确且不是从实验安全角度考虑的是( )

A. 操作①:使用稍浸入液面下的倒扣漏斗检验氢气的纯度
B. 操作②:使用CCl4萃取溴水中的溴时,振荡后需打开活塞使漏斗内气体放出
C. 操作③:吸收氨气或氯化氢气体并防止倒吸
D. 操作④:用食指顶住瓶塞,另一只手托住瓶底,把瓶倒立,检查容量瓶是否漏水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,由水电离产生的c(H+)和c(OH-)的乘积为1×10-18的溶液里,可能大量共存的离子组是
A. NH4+、Na+、Cl-、I- B. Na+、K+、Fe3+、SCN-
C. Na+、Al3+、Cl-、AlO2- D. Na+、K+、Cl-、HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国电池的年市场消费量约为80亿只,其中70%是锌锰干电池,利用废旧锌锰干电池制备硫酸锌晶体(ZnSO4·7H2O)和纯MnO2的工艺如下图所示:
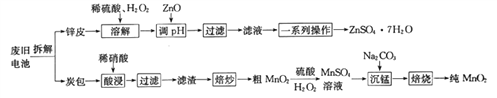
已知:
①锌皮的主要成分为Zn,含有少量Fe;炭包的主要成分为ZnCl2、NH4Cl、MnO2、碳粉等,还含有少量的 Cu、Ag、Fe 等。
②Ksp[Zn(OH)2]=2.0×10-16;Ksp[Fe(OH)2]=8.0×10-16;Ksp[Fe(OH)3]=4.0×10-38。
(1)除去炭包中碳粉的操作为_____________。
A.酸浸 B.过滤 C.焙炒 D.焙烧
(2)粗MnO2转化为MnSO4时,主要反应的离子方程式为_____________________。
(3)焙烧时发生反应的化学方程式为_____________。
(4)制备硫酸锌晶体流程中,用ZnO调节溶液pH的目的是______________________________,若溶解时不加H2O2带来的后果是____________________。
(5)“草酸钠-高锰酸钾返滴法”可测定MnO2的纯度:取agMnO2样品于锥形瓶中,加入适量稀硫酸,再加入V1mLc1mol·L-1Na2C2O4溶液(足量),最后用c2mol·L-1的KMnO4溶液滴定剩余的Na2C2O4,达终点时消耗V2 mL标准KMnO4溶液。
①MnO2参与反应的离子方程式为_____________。
②该样品中MnO2的质量分数为__________________(假定杂质不参与反应,列出表达式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. 等质量的乙烯和乙醇完全燃烧,消耗O2的物质的量相同
B. 乙醇与浓硫酸混合,加热至170℃制乙烯的反应属于消去反应
C. 用酸性重铬酸钾溶液检验酒驾,发生的反应属于乙醇的氧化反应
D. 乙醛使溴水或酸性KMnO4溶液褪色均属于氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有兴趣研究小组用工业废渣(主要成分为Cu2S和Fe2O3)制取氯化亚铜并同时生成电路板蚀刻液。资料显示:氯化亚铜(化学式为CuCl)常用作有机合成工业中的催化剂,通常是一种白色粉末,微溶于水、不溶于乙醇,在潮湿空气中易水解氧化成绿色;见光则分解。
他们设计流程如下:
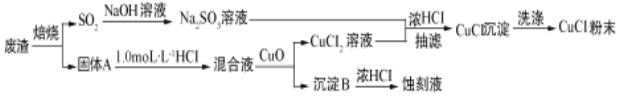
据此流程和以上信息回答下列问题:
(1)验证焙烧气体产物是SO2的方法______________________________________;溶解固体A对应的化学方程式为_____________________________________。
(2)SO2吸收用NaOH溶液,为得到纯净的Na2SO3溶液,其操作应为_____________________________________________________________________。
(3)在Na2SO3的水溶液中逐滴加入CuCl2溶液,再加入少量浓盐酸混匀,倾出清液,抽滤即得CuCl沉淀.写出该反应的离子方程式______。
(4)CuCl沉淀的洗涤需要经过酸洗、水洗和醇洗,水洗操作为____________________;醇洗不能省略,原因是______。
(5)得到CuCl沉淀要迅速真空干燥、冷却,密封包装。这样操作的目的是_______________________________________________________。
(6)氯化亚铜在热水中迅速与水反应生成砖红色固体,写出该反应的化学方程式_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在航天飞机返回地球大气层时,为防止其与空气剧烈摩擦而被烧毁,需在航天飞机外表面安装保护层.该保护层的材料可能为( )
A.铝合金
B.合金钢
C.新型陶瓷
D.塑料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是
A. NA个H2分子占有的体积一定为22.4 L
B. 标准状况下,22 g CO2与11.2 LH2O含有相同的原子数
C. 标准状况下,16g O2与O3的混合气体中含有的原子总数为NA
D. 1 mol/L的蔗糖水溶液中含蔗糖分子的数目为NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com