
 ��ʵ�����п�ͨ�����·�Ӧ��ȡ���������Na2S2O3��2Na2S+Na2CO3+4SO2�T3Na2S2O3+CO2
��ʵ�����п�ͨ�����·�Ӧ��ȡ���������Na2S2O3��2Na2S+Na2CO3+4SO2�T3Na2S2O3+CO2

 ��ѧ�����ϵ�д�
��ѧ�����ϵ�д� �·Ƿ��̸����100��ϵ�д�
�·Ƿ��̸����100��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����Ag2CrO4����Һ�м���AgNO3��Һ��Ag2CrO4��Ksp��С |
| B����0.001 mol?L-1��AgNO3��Һ��μ��뵽��Cl-��CrO42-Ũ�Ⱦ�Ϊ0.001 mol?L-1����Һ�У����Ȳ���AgCl���� |
| C������AgCl��Һ�뱥��Ag2CrO4��Һ��ȣ�ǰ�ߵ�c��Ag+���� |
| D�����¶��£�AgCl��ˮ�е��ܽ��С����ʳ��ˮ�е��ܽ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��������Ȼ�ѧ����ʽ����ѧ����ʽ���缫��Ӧʽ������ʽ�ȣ�����д��
��������Ȼ�ѧ����ʽ����ѧ����ʽ���缫��Ӧʽ������ʽ�ȣ�����д���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
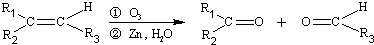 ��R1��R2��R3����������
��R1��R2��R3����������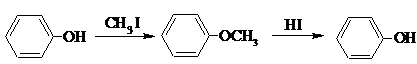
 ��
��
 �������ѣ���ͬϵ���ͨʽΪ��
�������ѣ���ͬϵ���ͨʽΪ��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ���� | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��Ksp���¶��й� |
| B������Ksp��ZnS����Ksp��CuS��������ZnS������һ�������¿�ת��ΪCuS���� |
| C����AgCl�������ܽ�ƽ���м���NaCl���壬AgClƽ�ⲻ�ƶ� |
| D������Ca��OH��2��Һ��FeCl2��Һ�м�����ϡ���ᣬ�������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

| A����t��ʱ��Ag2CrO4��KspΪ1��10-9 |
| B���ڱ���Ag2CrO4��Һ�м���K2CrO4��ʹ��Һ��Y�㵽X�� |
| C����t��ʱ����0.01 mol/LAgNO3��Һ�ζ�20 mL 0.01 mol/LKCI��0.01 mol/L��K2CrO4�Ļ����Һ��CrO42-�ȳ��� |
| D����t��ʱ����ӦAg2CrO4��s��+2 Cl-��aq��?2AgCl��s��+CrO42-��aq����ƽ�ⳣ��K=2.5��107 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com