
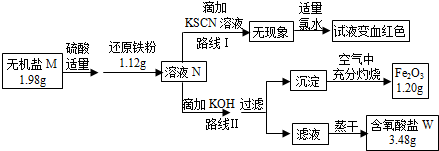
���� 1.2g�����������ʵ���Ϊ��$\frac{1.2g}{160g/mol}$=0.0075mol������ҺN�к�����Ԫ�ص����ʵ���Ϊ��0.0075mol��2��2=0.03mol������Ϊ��56g/mol��0.03mol=1.68g��1.12g����������M��һ������FeԪ�أ���ԭ������M����Ԫ�ص����ʵ���Ϊ0.03mol-0.02mol=0.01mol���������EΪNa2SO4��2.84g Na2SO4���ʵ���Ϊ0.02mol��������W�к���Ԫ�أ�����WΪ����������ҷ����е�ԭ�Ӹ�����Ϊ1��2��4���ɵ�M�Ļ�ѧʽΪK2FeO4��
��1��·�ߢ�Ϊ�����������ӵķ�����
��2��K2FeO4��ϡ���ᡢ���۷�Ӧ������������������غ�ˮ�����������غ��֪WΪ����أ�����n=$\frac{m}{M}$�����K2FeO4�����ʵ������ٸ���n=nM����������ӵ�������
��3������K2FeO4��ϡ���ᡢ���۷�Ӧ������������������غ�ˮд����Ӧ�Ļ�ѧ����ʽ��
��� �⣺1.2g�����������ʵ���Ϊ��$\frac{1.2g}{160g/mol}$=0.0075mol������ҺN�к�����Ԫ�ص����ʵ���Ϊ��0.0075mol��2��2=0.03mol������Ϊ��56g/mol��0.03mol=1.68g��1.12g����������M��һ������FeԪ�أ���ԭ������M����Ԫ�ص����ʵ���Ϊ0.03mol-0.02mol=0.01mol���������EΪNa2SO4��2.84g Na2SO4���ʵ���Ϊ0.02mol��������W�к���Ԫ�أ�����WΪ����������ҷ����е�ԭ�Ӹ�����Ϊ1��2��4���ɵ�M�Ļ�ѧʽΪK2FeO4��
��1������·�ߢ��֪��N��Һ��һ�������������ӣ��ʴ�Ϊ��Fe2+��
��2��1.2g�����������ʵ���Ϊ��$\frac{1.2g}{160g/mol}$=0.0075mol������Һ�к�����Ԫ�ص����ʵ���Ϊ��0.0075mol��2��2=0.03mol������Ϊ��56g/mol��0.03mol=1.68g��1.12g����������M��һ������FeԪ�أ�����M�����е�ԭ�Ӹ�����Ϊ1��2��4����M�Ļ�ѧʽΪ��K2FeO4���������̿�֪��K2FeO4��ϡ���ᡢ��ԭ���۷�Ӧ������������������أ����������غ��֪WΪ����أ�1.98gK2FeO4�����ʵ���Ϊ$\frac{1.98g}{198g/mol}$=0.01mol��0.01molK2FeO4�к���0.02mol�����ӣ����м����ӵ�����Ϊ39g/mol��0.02mol=0.78g��
�ʴ�Ϊ��K2SO4 ��0.78��
��3��1.66gNa2FeO4�����ʵ���Ϊ0.01mol��1.12g��ԭ���۵����ʵ���Ϊ0.02mol������Na2FeO4�뻹ԭ���۰����ʵ���֮��Ϊ1��2��Ӧ�Ļ�ѧ��Ӧ����Ϊ��2Fe+K2FeO4+4H2SO4�T3FeSO4+K2SO4+4H2O��
�ʴ�Ϊ��2Fe+K2FeO4+4H2SO4�T3FeSO4+K2SO4+4H2O��
���� ���⿼����̽��������ɵķ�������Ŀ�ѶȽϴ������漰������ɵIJⶨ��Ũ��������ʡ����ӷ���ʽ����ѧ����ʽ����д�����ӵļ��鷽����֪ʶ������֪ʶ��϶࣬�ۺ��Խ�ǿ����ֿ�����ѧ�����Ӧ�û���֪ʶ��������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������������������Һ������Ļ��Dz��ܽ� | |
| B�� | ��pH��ֽ����������� | |
| C�� | ����KSCN��Һ����Һ��Ѫ��ɫ | |
| D�� | ��Һ��dz��ɫ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
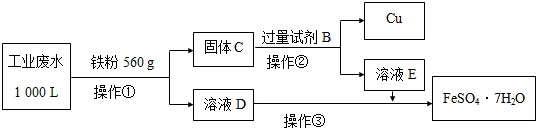
| ���� | Fe3+ | Cu2+ | SO42- | Na+ | H+ |
| Ũ��/��mol/L�� | 2��10-3 | 1��10-3 | 1��10-2 | 2��10-3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��Һ�й�������1��������ԭ��Ӧ | |
| B�� | ��Ӧǰ����Һ������Ũ�Ȼ������ֲ������NH4+��Na+ | |
| C�� | �н�״�������� | |
| D�� | ��Һ��ɫ�����仯 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
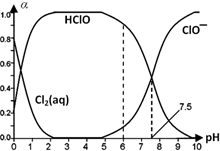 Cl2���仯�������������������й㷺��;���ش��������⣮
Cl2���仯�������������������й㷺��;���ش��������⣮ HClO+H++Cl-��Cl2��aq��+H2O
HClO+H++Cl-��Cl2��aq��+H2O HClO+HCl��HClO
HClO+HCl��HClO H++ClO-��
H++ClO-���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 22.2% | B�� | 30.0% | C�� | 75.7% | D�� | 80.6% |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
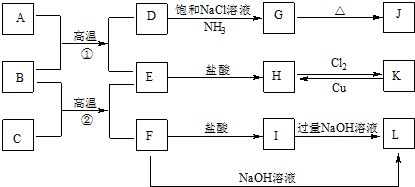
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com