


 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案科目:高中化学 来源: 题型:
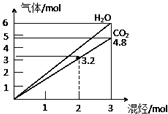 两种气态烃组成的混合气体,完全燃烧后得到CO2和H2O的物质的量随着混合烃物质的量的变化如图所示,则下列对混合烃的判断正确的是( )
两种气态烃组成的混合气体,完全燃烧后得到CO2和H2O的物质的量随着混合烃物质的量的变化如图所示,则下列对混合烃的判断正确的是( )| A、②⑤ | B、②④ | C、③④ | D、②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
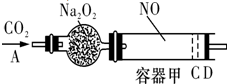 如图装置中,容器甲内充入1mol NO气体,干燥管内装有一定量Na2O2,从A处缓慢通入CO2气体.恒温下,容器甲中活塞缓慢由D向左移动,当移至C处时,容器体积缩小至最小,为原体积的
如图装置中,容器甲内充入1mol NO气体,干燥管内装有一定量Na2O2,从A处缓慢通入CO2气体.恒温下,容器甲中活塞缓慢由D向左移动,当移至C处时,容器体积缩小至最小,为原体积的| 9 |
| 10 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com