
| A、1 mol氯气参加氧化还原反应,转移的电子数一定为2NA |
| B、常温常压下,由6 g NO2和40 g N2O4组成的混合气体中原子总数为3NA |
| C、0.1 mol?L-1 NaF溶液中,HF和F-总和为0.1NA个 |
| D、12.5 mL 16 mol?L-1浓硫酸与足量铜反应,生成SO2的分子数为0.1NA |


科目:高中化学 来源: 题型:
| 微粒 | H+ | OH- | CH3COO- | CH3COOH |
| 物质的量浓度 | 减小 | 增大 | 增大 | 减小 |
| A、氯化氢 | B、氢氧化钠 |
| C、蒸馏水 | D、醋酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在饱和FeCl3溶液中逐滴加入NaOH溶液,产生红褐色沉淀 |
| B、实验时手指不慎划破,可从急救箱中取出FeCl3溶液止血 |
| C、清晨,在茂密的树林,常常可以看到从枝叶间透过的一道道光柱 |
| D、向豆浆中加入硫酸钙可制成可口的豆腐 |
查看答案和解析>>
科目:高中化学 来源: 题型:
2- 4 |
| 溶解 |
| ① |
| BaCl2 |
| ② |
| NaOH |
| ③ |
| Na2CO3 |
| ④ |
| 过滤 |
| ⑤ |
| 适量盐酸 |
| ⑥ |
| 蒸发、结晶、烘干 |
| ⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,1 mol 铁放入足量的浓硫酸中转移的电子数为0 | ||
B、标准状况下,密度为ρg?L-1的某气体纯净物一个分子的质量为
| ||
| C、将1mol Cl2通入到水中,得到的氯水中,N(HClO)+N(Cl-)+N(ClO-)<2NA | ||
| D、在含有4mol Si-O键的石英晶体中,氧原子的数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、过氧化钠固体与水反应:2O22-+2H2O=4OH-+O2↑ |
| B、H2SO4与Ba(OH)2溶液反应:Ba2++OH-+H++SO42-=BaSO4↓+H2O |
| C、过量的CO2通入Ca(ClO)2溶液中:ClO-+CO2+H2O=HCO3-+HClO |
| D、硫化钠水溶液呈碱性的原因:S2-+2H2O=H2S+2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、混合物:盐酸、漂白粉、水银 |
| B、化合物:BaCl2、HNO3、氨氷 |
| C、酸性氧化物:二氧化硅、一氧化碳、五氧化二磷 |
| D、电解质:纯碱、冰醋酸、BaSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
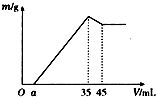 准确称取6g铝土矿样品(含Al2O3、Fe2O3、SiO2),放入100mL某浓度的HCl溶液中(SiO2不溶于HCl溶液),充分反应后过滤,向滤液中加入10mol/L的NaOH溶液,产生沉淀的质量m与加入NaOH溶液的体积的关系如图所示,求:
准确称取6g铝土矿样品(含Al2O3、Fe2O3、SiO2),放入100mL某浓度的HCl溶液中(SiO2不溶于HCl溶液),充分反应后过滤,向滤液中加入10mol/L的NaOH溶液,产生沉淀的质量m与加入NaOH溶液的体积的关系如图所示,求:查看答案和解析>>
科目:高中化学 来源: 题型:
 对叔丁基苯酚
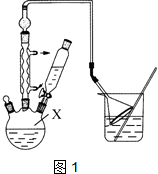
对叔丁基苯酚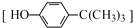 可用于生产油溶性酚醛树脂等.实验室以苯酚、叔丁基氯[(CH3)3CCl]等为原料制备对叔丁基苯酚的实验步骤如下:
可用于生产油溶性酚醛树脂等.实验室以苯酚、叔丁基氯[(CH3)3CCl]等为原料制备对叔丁基苯酚的实验步骤如下:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com