
| A. | CS2、H2O、C2H2都是直线形分子 | |
| B. | 非极性键只存在于双原子的单质分子(如Cl2)中 | |
| C. | CH2=CH2和CH≡CH分子中含有的π键个数相等 | |
| D. | CH4、CCl4、SiH4都是含有极性键的非极性分子 |
分析 A、根据中心原子的杂化类型判断分子的空间构型;
B、同种非金属元素原子间易形成非极性键;
C、双键中含有1个π键,三键中含有2个π键;
D、不同非金属元素原子间易形成极性键,分子结构对称、正负电荷中心重叠的分子为非极性分子.
解答 解:A、CS2和C2H2的中心原子都只含有2个价层电子对,属于sp杂化,没有孤电子对,分子构型为直线形,H2O中O原子的价层电子对数=2+$\frac{1}{2}$(6-2×1)=4,属于sp3杂化,而且含有2 个孤电子对,分子的空间构型为V形,故A错误;
B、同种非金属元素原子间易形成非极性键,化合物中也可能存在非极性键,如CH2=CH2中C与C之间为非极性键,故B错误;
C、双键中含有1个π键,三键中含有2个π键,则CH2=CH2中含有1个π键,CH≡CH分子中含有2个π键,二者的π键个数不相等,故C错误;
D、不同非金属元素原子间易形成极性键,分子结构对称、正负电荷中心重叠的分子为非极性分子,CH4、CCl4、SiH4都是含有极性键,CH4、CCl4、SiH4分子构型均为正四面体形,分子结构对称、正负电荷中心重叠属于非极性分子,故D正确.
故选D.
点评 本题考查了分子空间构型的判断、分子极性的判断、极性键和非极性键等,题目难度不大,侧重于基础知识的考查,注意把握价层电子对互斥理论的应用.


科目:高中化学 来源: 题型:选择题
| A. | 乙烷和乙烯的熔点都比CH4的高 | B. | 乙烷和乙烯都可发生加成反应 | ||
| C. | 乙烷能发生氧化反应 | D. | 苯和乙烯都是常见化工原料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 核内有8个中子的碳原子:$\stackrel{8}{6}$ C | B. | 氯离子的结构示意图: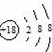 | ||
| C. | HCl的电子式: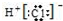 | D. | 甲烷分子的比例模型: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al2O3→Al(OH)3 | B. | Al→Na[Al (OH)4] | C. | Fe→Fe(OH)2 | D. | SiO2→H2SiO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | A | B | C | D |
| 性质或结构信息 | 工业上通过分离液态空气获得其单质,单质能助燃 | 气态氢化物显碱性 | +3价阳离子的核外电子排布与氖原子相同 | 第三周期原子半径最小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③ | B. | ①③⑤ | C. | ②④ | D. | ②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在生活舱中,可用过氧化钠制备氧气 | |
| B. | 金属镁可用作制造飞机、火箭的重要材料 | |
| C. | 在航天试验用的仪器仪表中大量使用了硅等非金属材料 | |
| D. | 返回舱外层的隔热瓦使用的是金属材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用玻璃棒蘸取0.01mol•L-1氢氧化钠溶液,点在广范pH试纸中部,与标准比色卡对照,测得其pH为12 | |
| B. | 向表面皿中加入少量胆矾,再加入约3mL浓硫酸,搅拌,观察到蓝色晶体变成白色粉末 | |
| C. | 在2只相同小烧杯中分别加入50mL物质的量浓度均为0.1mol•L-1的硫酸、醋酸溶液,进行导电性实验,接通电源,观察到硫酸的小灯泡比醋酸的小灯泡明亮,可得到的结论是,硫酸是强电解质,醋酸是弱电解质 | |
| D. | 在洁净的试管中加入2mL新制氯水,再向试管中加入几滴硝酸银和稀硝酸,产生白色沉淀,则证明新制氯水中含有Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com