
| A. | (3a+b)mol | B. | (3a+$\frac{b}{2}$)mol | C. | (3a+3p+$\frac{b}{2}$)mol | D. | (3a+$\frac{b}{2}$-3p)mol |
分析 混合气体消耗氧气的体积取决于C、H元素的物质的量,反应前后C、H原子的物质的量不变,则所得平衡混和气体完全燃烧消耗氧气的量与原乙烯和氢气的混合气体消耗氧气的量一定相等,据此进行计算.
解答 解:a mol C2H4、b mol H2的混合气体完全燃烧消耗氧气的总物质的量为:amol×(2+$\frac{4}{4}$)+bmol×$\frac{2}{4}$=(3a+$\frac{b}{2}$)mol,
根据质量守恒定律,加成反应前后C、H原子的物质的量不变,
则所得平衡混和气体完全燃烧消耗氧气的量与原乙烯和氢气的混合气体消耗氧气的量一定相等,都为(3a+$\frac{b}{2}$)mol,
故选B.
点评 本题考查了混合物的计算,题目难度不大,注意掌握质量守恒定律在化学计算中的应用,试题侧重考查学生的分析能力及化学计算能力,要求学生平时多积累化学计算的方法与技巧.


 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案科目:高中化学 来源: 题型:选择题
| A. | 乙烯的结构简式:CH2CH2 | B. | 乙烯的分子式:C2H4 | ||
| C. | 乙酸的结构简式:C2H2O2 | D. | 丙烷分子的球棍模型是 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2和SiO2 | B. | NaCl和HCl | ||
| C. | (NH4)2CO3和CO(NH2)2 (尿素) | D. | NaH和KCl |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 沉淀X的成分是SiO2、Fe2O3 | |
| B. | 从蛇纹石组成看,其成分皆是碱性氧化物 | |
| C. | 溶液Y中的阳离子主要是Mg2+、Al3+、Fe3+、H+ | |
| D. | 在溶液Y中加入过量的氨水,过滤得到的沉淀是Al(OH)3、Fe(OH)3和Mg(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、X是中学化学常见物质,它们在一定条件下具有如下转化关系:A+X→B+C+H2O
A、B、C、X是中学化学常见物质,它们在一定条件下具有如下转化关系:A+X→B+C+H2O查看答案和解析>>
科目:高中化学 来源: 题型:解答题
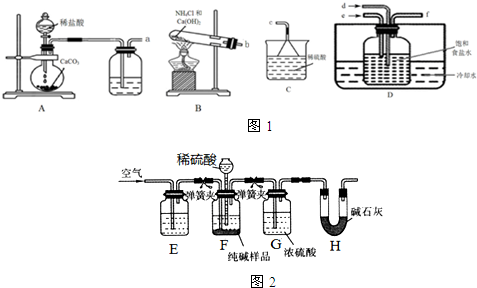
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解硫酸时,阴极产生1molH2时,阳极一定产生0.5molO2 | |
| B. | 盛有SO2的密闭容器中含有NA个氧原子,则SO2的物质的量为0.5mol | |
| C. | 电解1mol熔融的Al2O3,能产生33.6L氧气、54.0g金属铝 | |
| D. | 工业用电解法进行粗铜精炼时,每转移1mol电子,阳极上就溶解0.5NA个铜原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
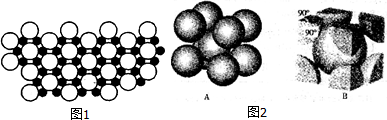
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 草酸可使酸性高锰酸钾溶液褪色,其离子方程式为:2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O | |
| B. | 向NH4Al(SO4)2溶液中加入过量的Ba(OH)2稀溶液:NH4++Al3++2SO42-+2Ba2++5OH-=2BaSO4↓+NH3•H2O+AlO2-+2H2O | |
| C. | NaHSO3溶液与FeCl3反应的离子方程式:SO32-+2Fe3++H2O=SO42-+2Fe2++2H+ | |
| D. | NH4HCO3溶液中加入少量NaOH:NH4++OH-═NH3•H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com