
| A. | 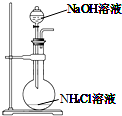 用装置图制取氨气 | B. | 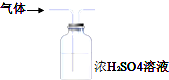 用装置图除去氨气中的水蒸气 | ||
| C. | 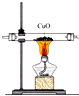 用装置图验证氨气具有还原性 | D. | 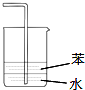 用装置图吸收氨气 |
分析 A.依据氨气极易溶液水的性质解答;
B.浓硫酸具有酸性,不能干燥碱性气体;
C.氨气与氧化铜若发生氧化还原反应则生成铜与氮气、水;
D.水的密度大于苯.
解答 解:A.氨气极易溶液水,氢氧化钠溶液与氯化铵溶液反应生成氯化钠、一水合铵,得不到氨气,故A错误;
B.氨气为碱性气体,不能用浓硫酸干燥,故B错误;
C.氨气与氧化铜反应生成铜与氮气、水,观察试管中固体颜色变化,即可验证氨气具有还原性,故C正确;
D.水的密度大于苯,氨气极易溶液水,不能防止倒吸的发生,可以选用四氯化碳和水混合物,故D错误;
故选:C.
点评 本题考查了氨气的制备和性质检验,明确氨气制备原理及氨气的性质是解题关键,注意发生装置的选择,注意氨气尾气处理应防止倒吸的发生,题目难度不大.


科目:高中化学 来源: 题型:解答题
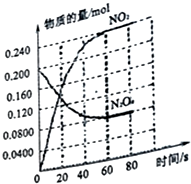 在容积为2.0L的容器中,通入一定量的N2O4,发生反应N2O4(g)?2NO2(g),随温度升高,混合气体颜色变深.回答下列问题:
在容积为2.0L的容器中,通入一定量的N2O4,发生反应N2O4(g)?2NO2(g),随温度升高,混合气体颜色变深.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 试管 | 操作 | 现象 |
| 1 | 加入碘水 | 溶液变成蓝色 |
| 2 | 加入银氨溶液,水浴加热 | 未出现银镜 |
| 3 | 加入碘水 | 溶液变成蓝色 |
| 4 | 加入银氨溶液,水浴加热 | 未出现银镜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,33.6 LSO3中含有氟原子的数目为1.5NA | |
| B. | 分子总数为NA的NO2和CO2混合气体中含有的氧原子数为2NA | |
| C. | 7.8 g Na2O2中含有的阴离子数为0.2NA | |
| D. | 1 molCl2参加反应转移电子数一定为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
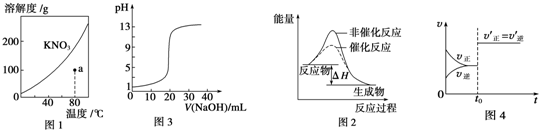
| A. | 图1表示KNO3的溶解度曲线,图中a点对应的溶液是80℃时KNO3的饱和溶液 | |
| B. | 图2表示某吸热热反应分别在有、无催化剂的情况下反应过程中的能量变化 | |
| C. | 图3表示0.1000 mol•L-1 NaOH溶液滴定20.00 mL 0.1000 mol•L-1醋酸溶液的滴定曲线 | |
| D. | 图4表示t0时改变的条件可能是增大压强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通入足量的二氧化碳后的溶液中Na+、$Al{O_2}^-、$$CH_3^{\;}CO{O^-}、$$C{O_3}^{2-}$ | |
| B. | 无色溶液中$M{g^{2+}}、Mn{O_4}^-、S{O_4}^{2-}、{I^-}$ | |
| C. | 酸性溶液中可能大量存在 $N{a^+}、Cl{O^-}、S{O_4}^{2-}、{I^-}$ | |
| D. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1012的溶液中$N{H_4}^+、C{l^-}$、Al3+、$N{O_3}^-$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
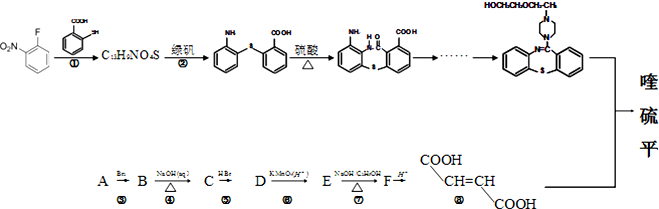
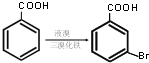 写出以甲苯为原料制备
写出以甲苯为原料制备 的合成路线.
的合成路线.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
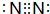 ;构成AlN的微粒是Al原子和N原子.
;构成AlN的微粒是Al原子和N原子.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
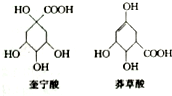 奎宁酸和莽草酸是某些高等植物特有的脂环状有机酸,常共存在一起,其结构简式如图所示.下列说法不正确的是( )
奎宁酸和莽草酸是某些高等植物特有的脂环状有机酸,常共存在一起,其结构简式如图所示.下列说法不正确的是( )| A. | 奎宁酸的相对分子质量比莽草酸的大18 | |
| B. | 可用高锰酸钾溶液鉴别奎宁酸和莽草酸 | |
| C. | 等物质的量的奎宁酸和莽草酸分别与足量Na反应,同温同压下产生H2的体积比为5:4 | |
| D. | 等物质的量的两种分别与足量NaOH溶液反应,消耗NaOH的物质的量相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com