
汽车尾气是造成大气污染的主要原因之一,在汽车排气管上安装“催化转换器”使汽车的尾气转换成无毒气体是目前最有效的手段之一。如果用 表示碳原子,用
表示碳原子,用 表示氧原子,用
表示氧原子,用 表示氮原子,如图为气体转换的微观过程。请你根据图示回答下列问题:
表示氮原子,如图为气体转换的微观过程。请你根据图示回答下列问题:
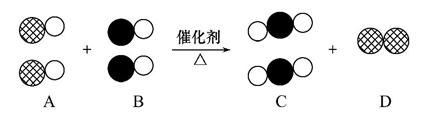
(1)A、B、C三种物质可以归为一类的依据是 。
(2)将C归为化合物,将D归为单质的理由是 。
(3)用化学反应方程式表示为 。
化学变化过程中消耗的A物质和生成的C物质的质量比为 。
(4)从微观的角度去描述你获得的关于化学变化的有关信息(答出一条即可)
。
(1)根据图示可知A、B、C、D分别是NO、CO、CO2和N2,NO、CO、CO2都属于氧化物,都含有氧元素。
(2)二氧化碳是由不同种原子构成的分子,属于化合物,而氮气是由同种原子构成的分子,属于单质。
(3)根据图示直接写出化学方程式即可。
(4)根据质量守恒定律,在化学变化过程中原子的种类、数目、质量没有发生改变,元素的种类和质量也没有发生改变,只有物质的种类和分子的种类发生了改变。
答案:(1)都由两种元素组成且都含有氧元素
(2)二氧化碳是由不同种原子构成的分子,而氮气是由同种原子构成的分子
(3) 15∶22
15∶22
(4)化学变化中原子的种类、数目、质量没有发生改变(其他合理答案也可)


 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案科目:高中化学 来源: 题型:
固体氧化物燃料电池是以固体氧化锆—氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过。该电池的工作原理如下图所示,其中多孔电极a、b均不参与电极反应。
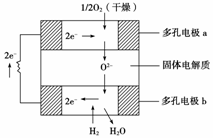
下列判断正确的是( )
A.有O2参加反应的a极为电池的负极
B.b极的电极反应式为H2+O2-—→H2O+2e-
C.a极对应的电极反应式为O2+2H2O+4e-—→4OH-
D.该电池的总反应式为2H2+O2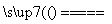 2H2O
2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
将0.20 mol NO和0.1 mol CO充入一个容积恒定为1L的密闭容器中发生反应:
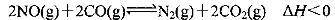
在不同条件下,反应过程中部分物质的浓度变化如图所示。
下列说法正确的是
A.容器内的压强不发生变化说明该反应达到平衡
B.当向容器中再充入0.20 mol NO时,平衡向正反应方
向移动,K增大
C.第12 min时改变的反应条件为升高温度
D.向该容器内充入He气,容器内气体压强增大,所以
反应速率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列各溶液的叙述中正确的是
A. NaHSO3与Na2SO3混合溶液中:3c(Na+)=c(HSO3-)+c(SO32-)
B. 0.1 mol/L 的醋酸钠溶液20 mL与0.1 mol/L盐酸10mL 混合后溶液显酸性:
c(CH3COO-)>c(CH3COOH)>c(Cl-)>c(H+)
C. 等物质的量浓度等体积的NH4HSO4和NaOH溶液混合:
c(Na+)=c(SO42-) >c ( NH4+)> c(H+)>c(OH-)
D. 向1.00L 0.3 mol/L NaOH溶液中缓慢通入0.2 mol CO2气体,溶液中:
c(Na+)>c(CO32-) >c(HCO3-)>c(OH-)> c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
如果实行海水淡化来供居民用水,下列方法中在原理上完全不可行的是
( )
A.加明矾使海水中的盐沉淀出来而淡化
B.利用太阳能使海水升温,通过蒸馏而使其淡化
C.将海水缓慢降温凝固以获取淡水
D.将海水通过离子交换树脂以除去各种离子
查看答案和解析>>
科目:高中化学 来源: 题型:
海带中含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:
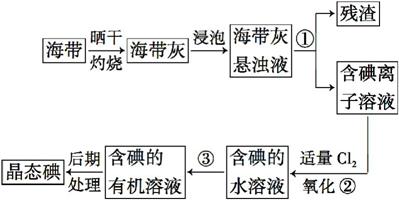
(1)步骤①的实验操作名称是 ;
(2)现有烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及必要的夹持仪器、物品。完成该实验尚缺少的玻璃仪器是 ;
(3)步骤③中能选用CCl4从碘水中萃取碘的原因是 ;
A.CCl4与水不互溶
B.CCl4可与I2发生取代反应
C.CCl4的密度比水大
D.CCl4不易燃烧,可作灭火剂
E.碘在CCl4中的溶解度比在水中大很多
(4)步骤③中还可选择 作萃取剂;
(5)步骤②中反应的离子方程式是 ;
(6)请设计一种简单的实验方法,检验提取碘后的水溶液中是否还含有单质碘: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室用乙酸和正丁醇制备乙酸正丁酯。有关物质的相关数据如下表:
| 化合物 | 相对分子质量 | 密度/g·cm-3 | 沸点,/℃ | 溶解度/l00g水 |
| 正丁醇 | 74 | 0.80 | 118.0 | 9 |
| 冰醋酸 | 60 | 1.045 | 118.1 | 互溶 |
| 乙酸正丁酯 | 116 | 0.882 | 126.1 | 0.7 |
操作如下:
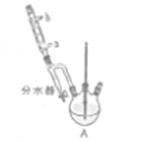
①在50mL三颈烧瓶中,加入18.5 mL正丁醇和13.4 mL冰醋酸, 3~4滴浓硫酸,投入沸石。安装分水器(作用:实验过程中不断分离除去反应生成的水)、温度计及回流冷凝管。
②将分水器分出的酯层和反应液一起倒入分液漏斗中,水洗,10% Na2CO3洗涤,再水洗,最后转移至锥形瓶,干燥。
③将干燥后的乙酸正丁酯滤入烧瓶中,常压蒸馏,收集馏分,得15.1 g乙酸正丁酯。
请回答有关问题:
(1)冷水应该从冷凝管 (填a或b)端管口通入。
(2)仪器A中发生反应的化学方程式为____ 。
(3)步骤①“不断分离除去反应生成的水”该操作的目的是: 。
(4)步骤②中,10%Na2CO3溶液洗涤有机层,该步操作的目的是 。
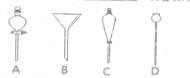
(5)进行分液操作时,使用的漏斗是 (填选项)。
(6)步骤③在进行蒸馏操作时,若从118℃开始收集馏分,产率偏 (填“高”或者“低”)原因是____
(7)该实验过程中,生成乙酸正丁酯的产率是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
在100 g碳不完全燃烧所得气体中,CO和CO2的体积比为1∶2,已知:
C(s)+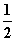 O2(g)===CO(g) ΔH1=-110.35 kJ·mol-1①
O2(g)===CO(g) ΔH1=-110.35 kJ·mol-1①
CO(g)+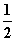 O2(g)===CO2(g) ΔH2=-282.57 kJ·mol-1②
O2(g)===CO2(g) ΔH2=-282.57 kJ·mol-1②
则与100 g碳完全燃烧相比,损失的热量是( )
A.392.92 kJ B.2 489.42 kJ C.784.92 kJ D.3 274.3 kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com