
| X | Y | |
| Z | W |
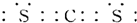 ;
;分析 短周期元素,Z元素原子的核外电子总数是其最外层电子数的3倍,设最外层为x,则(2+8+x)=3x,解得x=5,则Z为P;然后由元素周期表中的位置可知,X为C,Y为N,W为S,然后依据元素及其单质、化合物的性质来解答.
解答 解:(1)Z元素原子的核外电子总数是其最外层电子数的3倍,设最外层为x,则(2+8+x)=3x,解得x=5,则Z为P,原子结构中有3个电子层,最外层电子数为5,则位于元素周期表中的第三周期,第VA族,
故答案为:三;VA;
(2)非金属性越强,气态氢化物越稳定,X为C,Y为N,非金属性N>C,则气态氢化物的稳定性:NH3>CH4,
故答案为:NH3>CH4;
(3)XW2为CS2,CS2中C原子与S原子之间形成2对共用电子对,其电子式为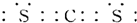 ,
,
故答案为: ;
;
(4)同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径P>S>C>N,
故答案为:P>S>C>N;
(5)只含共价键的化合物是共价化合物,CS2中只含S=C共价键,属于共价化合物,分子晶体存在分子间作用力,所以CS2中存在的微粒间作用力有:共价键和分子间作用力,
故答案为:共价化合物;共价键和分子间作用力.
点评 本题考查结构性质位置关系应用,难度不大,根据位置判断元素所处的周期是推断关键,注意掌握元素周期表的结构与元素周期律.


 快捷英语周周练系列答案
快捷英语周周练系列答案科目:高中化学 来源: 题型:选择题
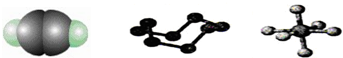
| A. | 32 g S8分子中含有0.125 mol σ键 | |
| B. | SF6是由极性键构成的非极性分子 | |
| C. | 1 mol C2H2分子中有3 mol σ键和2 mol π键 | |
| D. | 1 mol S8中含有8 mol S-S键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
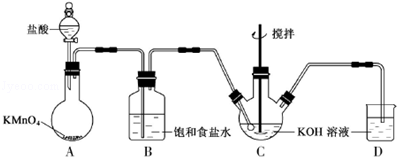
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
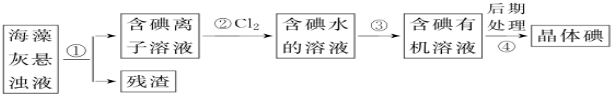
| A. | 步骤①、③的操作分别是过滤、萃取 | |
| B. | 可用硝酸银溶液检验步骤②的反应是否进行完全 | |
| C. | 步骤③中加入的有机溶剂是裂化汽油或四氯化碳 | |
| D. | 步骤④的操作是过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
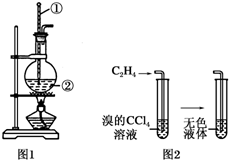 如图是实验室制乙烯的发生装置和乙烯性质实验装置,反应原理为:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2═CH2↑+H2O,回答下列问题:
如图是实验室制乙烯的发生装置和乙烯性质实验装置,反应原理为:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2═CH2↑+H2O,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
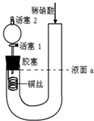 为证明稀硝酸与铜反应产物中气体为NO,设计如图实验(实验过程中活塞2为打开状态),下列说法中不正确的是( )
为证明稀硝酸与铜反应产物中气体为NO,设计如图实验(实验过程中活塞2为打开状态),下列说法中不正确的是( )| A. | 在装置左侧稍加热可以加快稀硝酸与铜的反应速率 | |
| B. | 关闭活塞1,加入稀硝酸至液面a处 | |
| C. | 通过关闭或开启活塞1可以控制反应的进行 | |
| D. | 反应开始后,胶塞下方有无色气体生成,还不能证明该气体为NO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在0.1 mol NaHSO4晶体中阳离子与阴离子总数为0.3NA | |
| B. | 25℃时,pH=13的1.0 LBa(OH)2溶液中含有的OH-数目为0.2NA | |
| C. | 常温常压下,4.4gCO2和N2O混合物中所含有的原子数为0.3 NA | |
| D. | 1L1 mol•L-1FeCl3完全水解生成NA个胶体粒子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入氯化钡溶液有白色沉淀生成,再加稀硝酸,沉淀不消失,原溶液含有SO42- | |
| B. | 某溶液先用稀硝酸酸化,再加入AgNO3溶液后有白色沉淀生成,证明原溶液中含有Cl- | |
| C. | 加入NaOH溶液并加热,有能使湿润的红色石蕊试纸变蓝的气体生成,则原溶液中一定含有NH4+ | |
| D. | 向某溶液中加入NaOH溶液,产生白色沉淀,白色沉淀迅速变成灰绿色,最终变成红褐色,说明原溶液中含有Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 297 | B. | 179 | C. | 118 | D. | 61 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com