
【题目】A~J是中学化学中常见的几种物质,它们之间的转化关系如图所示.已知常温下A为固体单质,B为淡黄色粉末,C、F、I为气态单质,E在常温下为液体,且E可由C、F化合生成,J可作杀菌消毒剂.
(1)写出B的电子式 .
(2)写出反应⑤的化学方程式: .
(3)写出反应⑦的离子方程式: .
(4)向AlCl3溶液中加入少量固体B,写出反应的化学方程式: .
(5)以Pt为电极电解滴加有少量酚酞的H饱和溶液,则极(填“阴”或“阳”)附近溶液先由无色变为红色,请说明理由: .
【答案】
(1)![]()
(2)2NaCl+2H2O ![]() 2NaOH+Cl2↑+H2↑
2NaOH+Cl2↑+H2↑
(3)Cl2+2OH﹣=Cl﹣+ClO﹣+H2O
(4)6Na2O2+4AlCl3+6H2O=4Al(OH)3↓+12NaCl+3O2↑
(5)阴;在阴极氢离子不断放电,破坏了水的电离平衡,促使水继续电离,导致溶液中氢氧根离子浓度大于氢离子浓度,所以阴极附近溶液变红
【解析】解:常温下A为固体单质,B为淡黄色粉末,C是气体,A和C反应生成B,则B是过氧化钠,A是钠,C是氧气;E在常温下为液体,E是水,钠和水反应生成氢氧化钠和氢气,过氧化钠和水反应生成氢氧化钠和氧气,C是氧气,D是氢氧化钠,F是氢气;H的水溶液通电生成氢气、I气体和氢氧化钠,且J可作杀菌消毒剂,为次氯酸盐,所以I是氯气,电解饱和食盐水制取氯气,所以H是氯化钠,氢气和氯气反应生成G,所以G是氯化氢;氯气和氢氧化钠反应生成氯化钠、次氯酸钠和水,所以J是次氯酸钠.(1)通过以上分析知,B是过氧化钠,电子式为 ![]() ,所以答案是:
,所以答案是: ![]() ;(2)电解饱和氯化钠溶液生成氯气、氢气和氢氧化钠,电解方程式为:2NaCl+2H2O
;(2)电解饱和氯化钠溶液生成氯气、氢气和氢氧化钠,电解方程式为:2NaCl+2H2O ![]() 2NaOH+Cl2↑+H2↑,所以答案是:2NaCl+2H2O
2NaOH+Cl2↑+H2↑,所以答案是:2NaCl+2H2O ![]() 2NaOH+Cl2↑+H2↑;(3)氯气和强碱反应生成氯化物、次氯酸盐和水,离子方程式为Cl2+2OH﹣=Cl﹣+ClO﹣+H2O,所以答案是:Cl2+2OH﹣=Cl﹣+ClO﹣+H2O;(4)过氧化钠和水反应生成氢氧化钠和氧气,少量氢氧化钠和氯化铝反应生成氢氧化铝和氯化钠,反应方程式为: 6Na2O2+4AlCl3+6H2O=4Al(OH)3↓+12NaCl+3O2↑,所以答案是:6Na2O2+4AlCl3+6H2O=4Al(OH)3↓+12NaCl+3O2↑;(5)电解饱和氯化钠溶液时,阳极上氯离子放电生成氯气,在阴极氢离子不断放电,破坏了水的电离平衡,促使水继续电离,导致溶液中氢氧根离子浓度大于氢离子浓度,所以阴极附近溶液变红,所以答案是:阴;在阴极氢离子不断放电,破坏了水的电离平衡,促使水继续电离,导致溶液中氢氧根离子浓度大于氢离子浓度,所以阴极附近溶液变红.
2NaOH+Cl2↑+H2↑;(3)氯气和强碱反应生成氯化物、次氯酸盐和水,离子方程式为Cl2+2OH﹣=Cl﹣+ClO﹣+H2O,所以答案是:Cl2+2OH﹣=Cl﹣+ClO﹣+H2O;(4)过氧化钠和水反应生成氢氧化钠和氧气,少量氢氧化钠和氯化铝反应生成氢氧化铝和氯化钠,反应方程式为: 6Na2O2+4AlCl3+6H2O=4Al(OH)3↓+12NaCl+3O2↑,所以答案是:6Na2O2+4AlCl3+6H2O=4Al(OH)3↓+12NaCl+3O2↑;(5)电解饱和氯化钠溶液时,阳极上氯离子放电生成氯气,在阴极氢离子不断放电,破坏了水的电离平衡,促使水继续电离,导致溶液中氢氧根离子浓度大于氢离子浓度,所以阴极附近溶液变红,所以答案是:阴;在阴极氢离子不断放电,破坏了水的电离平衡,促使水继续电离,导致溶液中氢氧根离子浓度大于氢离子浓度,所以阴极附近溶液变红.


科目:高中化学 来源: 题型:
【题目】已知A,B,C,D,E,F,G是七种原子序数依次增大的短周期元素,它们的原子结构特征或有关物质的性质等如表所示.
元素 | 原子结构特征或有关物质的性质 |
A | 原子的最外层电子数是其内层电子数的2倍 |
B | 其单质是空气中含量最多的物质 |
C | 原子的最外层电子数是其电子层数的4倍 |
D | 位于第ⅡA族,其原子半径比E的大 |
E | 是金属元素,其氧化物和氢氧化物都有两性,且与D在同一周期 |
F | 原子序数16,其单质在通常状况下为固体 |
G | 原子的最外层电子数比其次外层电子数少1个 |
(1)元素F在元素周期表中的位置是 . 这七种元素中,不属于主族元素的元素的名称是 .
(2)在E,F,G三种元素中,原子半径最小的是(填元素符号).
(3)元素A与G可形成化合物AG4 , 在该化合物中含有的化学键类型为 , 分子的空间结构为 . A与氧元素可形成化合物AO2 , 该化合物分子的电子式为 .
(4)元素B能与氢元素形成化合物BH3 , 在通常状况下,BH3的水溶液呈(填“酸”、“碱”或“中”)性,原因为(用方程式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学想研究氨基酸的分离和鉴定的方法,已知实验室中有0.5%的赖氨酸、脯氨酸、缬氨酸、苯丙氨酸、亮氨酸溶液以及它们的混合液(各组份浓度均为0.5%);现提供如下器材和试剂:A.器材:层析缸、毛细吸管、喷雾器、滤纸、其他相关器材(剪刀、铅笔、透明胶带等);
B.试剂:层析液(4份水饱和的正丁醇和1份醋酸的混合物)、0.1%茚三酮溶液.
若该同学想证明混合液确实含有上述5种氨基酸,请利用题目所给条件设计试验:
(1)实验原理:①所有氨基酸和一切蛋白质都能和茚三酮发生颜色反应
②在一定条件下,不同的氨基酸在层析液中的不同,所以在滤纸上的扩散速度不同,从而出现在滤纸的不同位置上
(2)实验步骤:①取层析滤纸一张,剪成20厘米长、14厘米宽的滤纸条,在纸的一端距边缘 2~3 厘米处用铅笔画一条直线,在此直线上每间隔2厘米作一记号,共需作处记号;
②用吸取氨基酸样品点在标记上,干燥后重复2﹣3次.
③将处理好的滤纸条卷成筒状用透明胶带固定,放入加好了层析液的层析缸中,待层析液上升到一定阶段时取出滤纸,自然风干;本步骤需要注意的是:点样的一端在下;层析液的液面要(填“高于”或“低于”)点样线.
④用喷雾器向滤纸上均匀喷上 , 待干燥后观察并记录层析斑点的位置.
(3)已知5种氨基酸的扩散速度为:赖氨酸<脯氨酸<缬氨酸<苯丙氨酸<亮氨酸.如图为实验结果,不同氨基酸用1~5表示,请问图中标号为3的氨基酸是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下列四种有机物的分析,正确的是( ) 
A.水杨酸和茉莉醛均能发生银镜反应
B.乙酰水杨酸可以由水杨酸发生酯化反应生成
C.四种有机物都含有碳碳双键,都能和氢气发生加成反应
D.四种机物中只有乙酰水杨酸能发生水解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国在CO2催化加氢制取汽油方面取得突破性进展,CO2转化过程示意图如下:

回答下列问题:
(1)二氧化碳分子中的化学键是_________________,物质乙的化学式是______________。
(2)写出反应①的化学方程式__________________________________。
(3)实验室常用纯净碳酸钙与稀盐酸反应制取二氧化碳气体,反应过程中产生二氧化碳的速率V(CO2) 与时间关系如下图:

①由图像分析,化学反应速率最快一段是___________。
②为了增大上述化学反应的反应速率,欲向溶液中加入下列物质,你认为可行的是_________(填写序号)。
A.蒸馏水 B.氯化钠溶液 C.浓盐酸 D.加热
(4)二氧化碳能与氢氧化钠溶液反应,当氢氧化钠过量时反应生成碳酸钠,当氢氧化钠少量时反应生成碳酸氢钠。当二氧化碳与氢氧化钠反成的物质的量比为2:3时,溶液中的溶质是_______________。
(5)从原子结构角度说明氧原子得电子能力强于碳原子:___________________________________。
(6)在一定条件下,工业上也可用CO2合成甲醇(CH3OH),其化学方程式为:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)。 将a molCO2与bmolH2充入容积为2L的密闭容器中发生上述反应,t min时测得甲醇的物质的量为c mol。计算0-t min内CO2的反应速率为_________ mol·L-1·s-1。 [X 的反应速率ν(X)=X的物质的量浓度变化/变化需要的时间]
CH3OH(g)+H2O(g)。 将a molCO2与bmolH2充入容积为2L的密闭容器中发生上述反应,t min时测得甲醇的物质的量为c mol。计算0-t min内CO2的反应速率为_________ mol·L-1·s-1。 [X 的反应速率ν(X)=X的物质的量浓度变化/变化需要的时间]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应H2(g) +I2(g)![]() 2HI(g)中,每生成2 mol HI时会有a kJ 的能量放出,又知有关化学键键能如下:
2HI(g)中,每生成2 mol HI时会有a kJ 的能量放出,又知有关化学键键能如下:
![]()
下列说法正确的是
A. 1mol H2 的能量比2 mol H 的能量高
B. 将0.5 mol H2 与1mol I2(g)混合充分反应后放出的热量为0.5a kJ
C. H- I键的键能为0.5(a+b+c) kJ/mol
D. H +I![]() HI 是吸热变化
HI 是吸热变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色透明的溶液中,能大量共存的离子组是( )
A. Na+、H+、SO42-、HCO3- B. Cu2+、K+、SO42-、NO3-
C. Na+、K+、Cl-、NO3- D. Ba2+、K+、SO42-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~J为中学化学中常见的几种物质.它们有如图转化关系:常温下,A为生活中常见的无色无味液体,F、I为气体单质,B、D为常见金属,I分子中电子总数为34.H既能与酸反应,又能与碱反应.回答下列问题:
(1)写出下列物质的化学式:A , C;
(2)写出工业上冶炼D的化学方程式:;
(3)写出E与氢碘酸发生氧化还原反应的离子方程式:
(4)证明G中含有B元素的方法是(写出操作、现象及结论)
(5)从J的水溶液中获取J的晶体,应首先向J的水溶液中通人C的原因是 , 然后的实验操作是、过滤、洗涤、干燥.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组利用文献资料设计方案对氯及其化合物进行探究.
(1)Ⅰ.用高锰酸钾和浓盐酸反应制取氯气 a.该小组利用下图装置及试剂制备并收集适量Cl2 , 装置B、C的作用分别是、 . 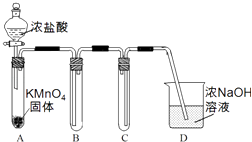
b.制得的氯气中加入适量水,得到饱和氯水,
饱和氯水中含氯元素的微粒有(写出全部微粒).
c.饱和氯水与石灰石的反应是制取较浓HC1O溶液的方法之一.在过量的石灰石中加入饱和氯水充分反应,有少量气泡产生,溶液浅黄绿色褪去,过滤,得到的滤液其漂白性比饱和氯水更强.
①滤液漂白性增强的原因是(用化学平衡移动原理解释).
②饱和氯水与石灰石反应生成HClO的方程式是 .
(2)ClO3﹣、Cl﹣和H+反应的探究 a.KClO3、KCl与硫酸可以反应.该小组设计了系列实验研究反应条件对反应的影响,实验记录如下(实验在室温下进行):
烧杯编号 | 1 | 2 | 3 | 4 |
氯酸钾饱和溶液 | 1mL | 1mL | 1mL | 1mL |
氯化钾固体 | 1g | 1g | 1g | 1g |
水 | 8mL | 6mL | 3mL | 0mL |
硫酸(6mol/L) | 0mL | 2mL | ()mL | 8mL |
现象 | 无现象 | 溶液呈浅黄色 | 溶液呈黄绿色,生成浅黄绿色气体 | 溶液呈黄绿色, |
①该系列实验的目的 .
②烧杯3取用硫酸的体积应为mL.
b.该小组同学查资料得知:将氯酸钾固体和浓盐酸混合也能生成氯气,同时有大量ClO2生成;ClO2沸点为10℃,熔点为﹣59℃,液体为红色;Cl2沸点为﹣34℃,液态为黄绿色.设计最简单的实验验证Cl2中含有ClO2 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com