
| A. | -69.4kJ•mol-1 | B. | -45.2kJ•mol-1 | C. | +69.4kJ•mol-1 | D. | +45.2kJ•mol-1 |
分析 由题意知MOH是弱碱:MOH(aq)+H+(aq)═M+(aq)+H2O(l)△H1=-12.1 kJ•mol-1①,H+(aq)+OH-(aq)═H2O(l)△H2=-57.3 kJ•mol-1②,根据盖斯定律构造MOH(aq)??M+(aq)+OH-(aq)并计算焓变.
解答 解:常温下,0.01mol•L-1 MOH溶液的pH为10,说明MOH是弱碱:MOH(aq)+H+(aq)═M+(aq)+H2O(l)△H1=-12.1 kJ•mol-1①,
H+(aq)+OH-(aq)═H2O(l)△H2=-57.3 kJ•mol-1②,
根据盖斯定律,由①-②得:MOH(aq)??M+(aq)+OH-(aq)△H=(-12.1+57.3)kJ•mol-1=+45.2 kJ•mol-1,
故选:D.
点评 本题考查了弱电解质的判断和反应热的计算,综合性较强,注意弱电解质的判断和利用盖斯定律进行构造目标热化学方程式并计算焓变是解题的关键.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
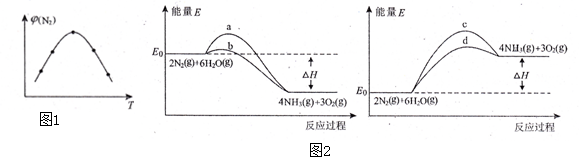
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
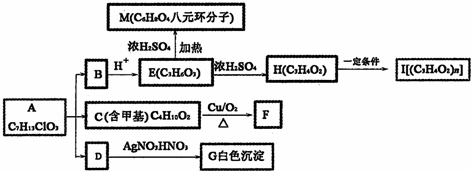
 +O2$→_{△}^{Cu}$
+O2$→_{△}^{Cu}$ +2H2O;②E→M:2HOCH2CH2COOH$→_{△}^{浓H_{2}SO_{4}}$
+2H2O;②E→M:2HOCH2CH2COOH$→_{△}^{浓H_{2}SO_{4}}$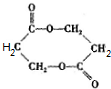 +2H2O;
+2H2O;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验方案 | 现象及结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
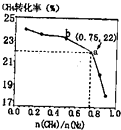 CH4、和N2在一定条件下能直接生成氨:3CH4(g)+2N2(g)$?_{催化剂}^{700℃}$3C(s)+4NH3(g)△H>0,700℃时,$\frac{n(C{H}_{4})}{n({N}_{2})}$与CH4的平衡转化率的关系如图所示.下列判断正确的是( )
CH4、和N2在一定条件下能直接生成氨:3CH4(g)+2N2(g)$?_{催化剂}^{700℃}$3C(s)+4NH3(g)△H>0,700℃时,$\frac{n(C{H}_{4})}{n({N}_{2})}$与CH4的平衡转化率的关系如图所示.下列判断正确的是( )| A. | $\frac{n(C{H}_{4})}{n({N}_{2})}$越大,CH4的转化率越高 | |
| B. | $\frac{n(C{H}_{4})}{n({N}_{2})}$与不变时,升温,NH3的体积分数会减小 | |
| C. | b点对应的平衡常数比a点的大 | |
| D. | a点对应的NH3的体积分数约为13% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com