
 完成下列各题:
完成下列各题:
| ||
| △t |
| 3 |
| 2 |
| 1 |
| 2 |
| ||
| 10min |
| 0.2mol |
| 1mol |
 ,
, ;
;

科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2014届福建德化三中高二上学期第二次月考理科化学试卷(解析版) 题型:填空题
(10分)(1)一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO)∶ CO(g)+2H2(g) CH3OH(g).
CH3OH(g).
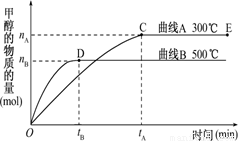
根据题意和所给图象完成下列各题:
①反应达到平衡时,平衡常数表达式K= ,
②升高温度,K值 (填“增大”“减小”或“不变”)
(2)一定温度下,将3 mol A气体和1 mol B气体通入一密闭容器中,发生如下反 应:3A(g) + B(g) xC(g) 请填写下列空白:若容器体积固定为2 L,反应2 min时测得剩余0.6 mol B,C的浓度为0.4 mol/L。
xC(g) 请填写下列空白:若容器体积固定为2 L,反应2 min时测得剩余0.6 mol B,C的浓度为0.4 mol/L。
①x=
②平衡混合物中,C的体积分数为50%,则B的转化率是______________。
(3)运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。有人设想寻求合适的催化剂和电极材料,以N2、H2为电极反应物,以HCl—NH4Cl为电解质溶液制造新型燃烧电池,放电过程中,溶液中铵根离子浓度逐渐增大。请写出该电池的正极反应式 。
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:
根据所学知识,完成下列各题
(1)在课堂上,老师演示金属钠与硫酸铜溶液反应时,同学们观察到该反应生成了蓝色沉淀,而没有铜单质生成。老师对此现象做出了如下解释:钠与硫酸铜溶液接触时,首先与水反应,反应的化学方程式为:______________________________________________________________, 然后生的氢氧化钠再与硫酸铜反应,反应的离子方程式为:________________________________________________________________________。
(2)工业上利用氯气与石灰乳反应制取漂白粉。请写出该反应的化学方程式:_______________________________________________________________________ ,当有1molCl2参加反应时转移电子数____________个
查看答案和解析>>
科目:高中化学 来源:2012-2013学年安徽省宿州市十三校高一(上)期中化学试卷(解析版) 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com