有关pH的计算
(1)20mL0.01mol/LKOH溶液的pH为?
(2)30mL0.005mol/LH2SO4溶液的pH为?
(3)两溶液混合后,溶液的pH为?
【答案】
分析:(1)20mL0.01mol/LKOH溶液中c(OH
-)=0.01mol/L,根据Kw=c(H
+)?c(OH
-)计算溶液中c(H
+),再根据pH=-logc(H
+)计算溶液的pH值;
(2)30mL0.005mol/LH
2SO
4溶液中c(H
+)=0.005mol/L×2=0.01mol/L,根据pH=-logc(H
+)计算溶液的pH值;
(3)KOH溶液中c(OH
-)=0.01mol/L,H
2SO
4溶液中c(H
+)=0.005mol/L×2=0.01mol/L,硫酸的体积多,故混合后溶液成酸性,据此混合后溶液中c(H
+),根据pH=-logc(H
+)计算溶液的pH值.
解答:解:(1)20mL0.01mol/LKOH溶液中c(OH
-)=0.01mol/L,故溶液中c(H
+)=
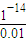
mol/L=10
-12mol/L,故该溶液的pH=-log10
-12=12,
答:0.01mol/LKOH溶液的pH为12;
(2)30mL0.005mol/LH
2SO
4溶液中c(H
+)=0.005mol/L×2=0.01mol/L,故该溶液的pH=-log0.01=2,
答:0.005mol/LH
2SO
4溶液的pH为2;
(3)KOH溶液中c(OH
-)=0.01mol/L,H
2SO
4溶液中c(H
+)=0.005mol/L×2=0.01mol/L,硫酸的体积多,故混合后溶液呈酸性,胡混合后溶液中c(H
+)=
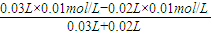
=0.002mol/L,故混合后溶液的pH=-log0.002=2.7,
答:混合后溶液的pH值为2.7.
点评:本题考查溶液pH值的有关计算,比较基础,注意碱性溶液中先加入氢氧根离子浓度,再根据水的离子积计算溶液中氢离子浓度,最后根据pH定义计算.

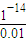 mol/L=10-12mol/L,故该溶液的pH=-log10-12=12,
mol/L=10-12mol/L,故该溶液的pH=-log10-12=12,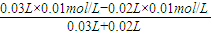 =0.002mol/L,故混合后溶液的pH=-log0.002=2.7,
=0.002mol/L,故混合后溶液的pH=-log0.002=2.7,

 名校课堂系列答案
名校课堂系列答案 (2011?深圳一模)氟和氟盐是化工原料.由于氟气性质活泼,很晚才制取出来.
(2011?深圳一模)氟和氟盐是化工原料.由于氟气性质活泼,很晚才制取出来.