
| A. | ②⑤⑥ | B. | ①②⑤ | C. | ③④⑥ | D. | ③④⑤ |
分析 ①溶解性大小与酸的电离的程度无关;
②酸与碱发生中和反应无法确定酸电离的程度;
③苯酚与氯化铁溶液发生显色反应;
④溴与苯酚发生取代反应,不能比较酸性强弱;
⑤苯酚不能使能紫色石蕊指示剂变红;
⑥苯酚的酸性弱于碳酸,碳酸氢根离子的电离大于苯酚.
解答 解:①苯酚的浑浊液加热后变澄清,说明温度升高苯酚溶解度增大,无法说明苯酚的酸性,故①不选;
②苯酚的水溶液中加NaOH溶液,生成苯酚钠,能说明苯酚溶液呈酸性,故②选;
③苯酚与氯化铁溶液发生显色反应,无法说明苯酚的酸性,故③不选;
④苯酚与氯化铁溶液发生显色反应,无法说明苯酚的酸性,故④不选;
⑤苯酚溶液中滴加紫色石蕊指示剂不变色,说明苯酚酸性弱,电离出的氢离子不足以使指示剂变色,故⑤选;
⑥苯酚能与Na2CO3溶液反应生成NaHCO3,说明苯酚酸性比弱酸碳酸弱,故⑥选;
故选A.
点评 本题考查了苯酚的性质,题目难度不大,注意苯酚和氯化铁变色反应无法判断酸性强弱、苯酚的酸性很弱,不能使指示剂变色.


 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案科目:高中化学 来源: 题型:选择题
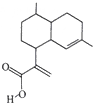 屠呦呦因对青蒿素的研究而获得诺贝尔生理学或医学奖,青蒿素可以青蒿酸(结构简式如图所示)为原料合成,下列关于青蒿酸的说法中正确的是( )
屠呦呦因对青蒿素的研究而获得诺贝尔生理学或医学奖,青蒿素可以青蒿酸(结构简式如图所示)为原料合成,下列关于青蒿酸的说法中正确的是( )| A. | 分子式为C15H24O2 | B. | 属子芳香族化合物 | ||
| C. | 能发生取代反应和加成反应 | D. | 分子中所有原子可能共平面 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | 甲 | 乙 | 丙 |
| 样品质量(g) | 9.6 | 12.8 | 64.0 |
| 气体体积(L) | 5.04 | 6.72 | V |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K=$\frac{[C]•[{H}_{2}O]}{[CO]•[{H}_{2}]}$ | B. | K=$\frac{[CO]•[{H}_{2}]}{[C]•[{H}_{2}O]}$ | C. | K=$\frac{[CO]•[{H}_{2}]}{[{H}_{2}O]}$ | D. | K=$\frac{[{H}_{2}O]}{[CO]•[{H}_{2}]}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Z元素的最高价氧化物对应的水化物酸性强于Y元素的最高价氧化物对应的水化物 | |
| B. | X、Y、Z形成的简单离子的半径大小:Yn->Zm->Xm- | |
| C. | 元素Z、Y分别与元素W形成的化合物的热稳定性:WmZ<WnY | |
| D. | 若HnY溶液的酸性比HmZ溶液的酸性强,则Y的非金属性比Z的强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 结构及性质 |
| A | A的原子半径最小 |
| B | B原子最外层电子数是次外层的两倍 |
| C | C元素在空气中含量最多 |
| D | D是短周期中金属性最强的元素 |
| E | E的最高价氧化物对应水化物是一种常见的两性氢氧化物 |
| R | R与B同主族 |
| T | T的负一价阴离子的核外电子排布与Ar原子相同 |
 .
. ;它可用于潜艇或呼吸面具的供氧剂,它与H2O反应的化学方程式为2Na2O2+2H2O=4NaOH+O2↑.
;它可用于潜艇或呼吸面具的供氧剂,它与H2O反应的化学方程式为2Na2O2+2H2O=4NaOH+O2↑.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室用H2O2分解制O2,加入MnO2后,反应速率明显加快 | |
| B. | 在金属钠与足量水反应中,增加水的量能加快反应速率 | |
| C. | 2SO2+O2?2SO3反应中,2molSO2在充足的氧气中不能得到2molSO3 | |
| D. | 实验室用碳酸钙和盐酸反应制取CO2,用碳酸钙粉末比块状反应要快 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com