
已知2H2(g)+O2(g)===2H2O(l);ΔH=-569.6 kJ·mol-1,
2H2O(g)===2H2(g)+O2(g);ΔH=+482.1 kJ·mol-1。
则1 g液态H2O蒸发时吸收的热量是( )
A.2.43 kJ B.4.86 kJ C.43.8 kJ D.87.5 kJ
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
某金属晶体M有两种堆积形式,如下图甲和乙,在T℃以上时甲可以转变为乙,这两种结构中最邻近的原子间距离相同。
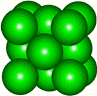

甲 乙
(1)乙的堆积方式称为 堆积;
甲和乙两种堆积方式中配位数之比为 ,晶胞边长之比为 。
(2)在T℃以下测定该金属晶体有关性质参数如下表所示。已知原子化热指1mol金属由固态转变为气态原子时所需要吸收的热量,是衡量金属键强弱的物理量。
| 金属 | 相对原子质量 | 密度/g·㎝-3 | 原子化热/kJ·mol-1 |
| Na | 22. 99 | 0. 960 | 108. 4 |
| M | 60. 20 | 7. 407 | 7735 |
预测该金属的熔点比Na (填“高”或“低”),由上述数据可计算M原子的原子半径为 pm。
(已知 ,7. 407≈
,7. 407≈ ,1pm=10
,1pm=10 m)
m)
查看答案和解析>>
科目:高中化学 来源: 题型:
铝土矿的主要成分为氧化铝、氧化铁和二氧化硅,工业上经过下列工艺可以冶炼金属铝:

下列说法中错误的是 ( )
A.①②中除加试剂外,还需要进行过滤操作
B.a、b中铝元素的化合价相同
C.③中需要通入过量的氨气
D.④进行的操作是加热,而且d一定是氧化铝
查看答案和解析>>
科目:高中化学 来源: 题型:
下表为长式周期表的一部分,其中的编号代表对应的元素。
| ① | ② | ||||||||||||||||
| ③ | ④ | ⑤ | |||||||||||||||
| ⑦ | ⑥ |
请回答下列问题:
(1) ①和⑤形成的一种常见溶剂的电子式为
(2) 元素⑦的基态原子的简化电子排布式为
(3) ②的氢化物与⑤的氢化物比较,沸点②的更高,热稳定性②的也更强。请分别说明理由: ;
 (4) 右图四条折线分别表示ⅣA族、ⅤA族、ⅥA族、ⅦA族元素气态氢化物的沸点变化,则④的氢化物所在的折线是 (填m、n、x或y)。
(4) 右图四条折线分别表示ⅣA族、ⅤA族、ⅥA族、ⅦA族元素气态氢化物的沸点变化,则④的氢化物所在的折线是 (填m、n、x或y)。
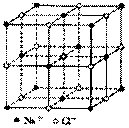
(5)③与⑤构成的晶体晶胞如下图所示。已知晶体的密度为r g / cm3,阿伏加德罗常数为NA,则在晶体里距离最近的离子③与⑤的间距大约是 cm. (列出算式即可,不必化简)
(6)元素⑥的单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。
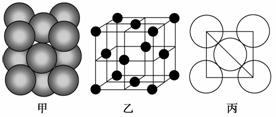
若元素⑥ 的原子半径为r cm,NA代表阿伏加德罗常数,则该晶体的密度可表示为
g / cm3。(列出算式即可,不必化简)
查看答案和解析>>
科目:高中化学 来源: 题型:
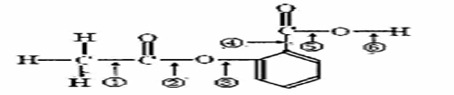
在阿斯匹林的结构简式(下图所示)中①②③④⑤⑥分别标出了其分子中的不同的键。
将阿斯匹林与足量NaOH溶液共煮时,发生反应时断键的位置是( )
A.①④
B.②⑤
C.②⑥
D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
在同温同压下,某有机物和过量Na反应得到V1 L氢气,另一份等量的该有机物和足量的NaHCO3溶液反应得到V2 L二氧化碳,若V1=V2≠0,则该有机物可能是( )

查看答案和解析>>
科目:高中化学 来源: 题型:
以天然气、焦炭、水、空气为初始原料,可以制得若干化工产品:
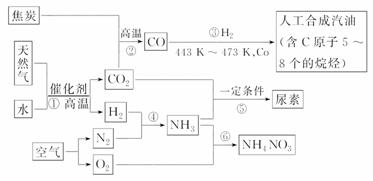
请回答下列问题:
(1)合成氨中原料气体N2来源于空气,可采用将空气________和________两种方法,H2可采用上述反应①,其化学方程式为____________________________________________。
(2)对于合成氨N2+3H2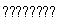 2NH3 ΔH<0,其中N2与H2体积比高于1∶3的原因是_______________________________;及时分离NH3的方法是_________________________。
2NH3 ΔH<0,其中N2与H2体积比高于1∶3的原因是_______________________________;及时分离NH3的方法是_________________________。
(3)制取NH4NO3时,NH3的用途有两种,制HNO3的量大于与HNO3反应的量的原因________________________________________________________________________。
(4)发生反应⑤的化学方程式为_____________________________________________。
(5)发生反应③生成C8H18的化学方程式为__________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com