
”¾ĢāÄæ”æ£Ø1£©¹¤ŅµÉĻ³£ŅŌ°±ĘųĪŖŌĮĻÖʱøĻõĖį£¬ĘäÖŠÓŠŅ»²½·Ē³£ÖŲŅŖµÄ·“Ó¦ĪŖ
4NH3+5O2![]() 4NO+6H2O£¬øĆ·“Ó¦µÄŃõ»Æ¼ĮĪŖ______£¬»¹Ō¼ĮĪŖ______”£ÓƵ„ĻßĒŷرķŹ¾øĆŃõ»Æ»¹Ō·“Ó¦µē×Ó×ŖŅʵķ½ĻņŗĶŹżÄæ____________________________________”£
4NO+6H2O£¬øĆ·“Ó¦µÄŃõ»Æ¼ĮĪŖ______£¬»¹Ō¼ĮĪŖ______”£ÓƵ„ĻßĒŷرķŹ¾øĆŃõ»Æ»¹Ō·“Ó¦µē×Ó×ŖŅʵķ½ĻņŗĶŹżÄæ____________________________________”£
ČōÓŠ±ź×¼×“æöĻĀVL°±ĘųĶźČ«·“Ó¦£¬²¢×ŖŅĘnøöµē×Ó£¬Ōņ°¢·üŁ¤µĀĀŽ³£Źż£ØNA£©æɱķŹ¾ĪŖ__________________£ØŠ“³öŗ¬n”¢VµÄ±ķ“ļŹ½£©”£
£Ø2£©Ä³Ņ»·“Ó¦ĢåĻµÖŠÓŠ·“Ó¦ĪļŗĶÉś³ÉĪļ¹²5ÖÖĪļÖŹ£ŗS”¢ H2S”¢HNO3”¢NO”¢H2O”£ŅŃÖŖĻõĖįŹĒŅ»ÖÖ·“Ó¦Īļ£¬øĆ·“Ó¦ÖŠ»¹Ō²śĪļŹĒ________£»Čō·“Ó¦ÖŠ×ŖŅĘĮĖ0.3molµē×Ó£¬ŌņŃõ»Æ²śĪļµÄÖŹĮæŹĒ_____g”£
£Ø3£©°“ŅŖĒóĢīæÕ£ŗ
¢Ł³żČ„Ģ¼ĖįĒāÄĘČÜŅŗÖŠµÄĢ¼ĖįÄĘ______________________£ØÓĆĄė×Ó·½³ĢŹ½±ķŹ¾ŌĄķ£©£»
¢Ś³żČ„Ģ¼ĖįÄĘČÜŅŗÖŠµÄĢ¼ĖįĒāÄĘ£¬Ó¦¼ÓŹŌ¼ĮĪŖ________________£»
¢ŪÓĆĒāŃõ»Æ±µ³żČ„Ć÷·ÆČÜŅŗÖŠµÄĮņĖįøł__________________£ØÓĆĄė×Ó·½³ĢŹ½±ķŹ¾ŌĄķ£©”£
”¾“š°ø”æO2 NH3 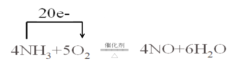 4.48n/Vmol-1 NO 4.8g CO32-+ H2O+ CO2 = 2HCO3- ŹŹĮæµÄĒāŃõ»ÆÄĘČÜŅŗ Al3+ + 2SO42- + 4OH- + 2Ba2+ = AlO2- + 2BaSO4”ż + 2H2O
4.48n/Vmol-1 NO 4.8g CO32-+ H2O+ CO2 = 2HCO3- ŹŹĮæµÄĒāŃõ»ÆÄĘČÜŅŗ Al3+ + 2SO42- + 4OH- + 2Ba2+ = AlO2- + 2BaSO4”ż + 2H2O
”¾½āĪö”æ
·“Ó¦ÖŠNŌŖĖŲ»ÆŗĻ¼ŪÓÉ-3¼ŪÉżøßµ½+2¼Ū£¬OŌŖĖŲ»ÆŗĻ¼ŪÓÉ0¼Ū½µµĶµ½-2¼Ū£¬½įŗĻ»ÆŗĻ¼ŪµÄ±ä»Æ½ā“šøĆĢā”£NŌŖĖŲ»ÆŗĻ¼ŪÓÉ-3¼ŪÉżøßµ½+2¼Ū£¬1mol°±Ęų·“Ó¦£¬×ŖŅĘ5molµē×Ó£»£Ø2£©øł¾ŻŃõ»Æ»¹Ō·“Ó¦¹ęĀÉ£¬ĻõĖįŹĒŅ»ÖÖ·“Ó¦Īļ£¬ŌņNOŹĒÉś³ÉĪļ£¬NŌŖĖŲ»ÆŗĻ¼Ū½µµĶ£¬ŌņĮņŌŖĖŲ»ÆŗĻ¼ŪÉżøߣ¬·¢Éś·“Ó¦ŹĒH2S![]() S£»·“Ó¦·½³ĢŹ½ŹĒ
S£»·“Ó¦·½³ĢŹ½ŹĒ![]() £»£Ø3£©¢ŁĶØČė¶žŃõ»ÆĢ¼æÉŅŌ³żČ„Ģ¼ĖįĒāÄĘČÜŅŗÖŠµÄĢ¼ĖįÄĘ£»¢ŚĢ¼ĖįĒāÄĘÓėĒāŃõ»ÆÄĘ·“Ӧɜ³ÉĢ¼ĖįÄĘŗĶĖ®£»¢ŪÓĆĒāŃõ»Æ±µ³żČ„Ć÷·ÆČÜŅŗÖŠĮņĖįøł£¬ŠčŅŖĆ÷·ÆÓėĒāŃõ»Æ±µµÄĪļÖŹµÄĮæ±ČĪŖ1:2”£
£»£Ø3£©¢ŁĶØČė¶žŃõ»ÆĢ¼æÉŅŌ³żČ„Ģ¼ĖįĒāÄĘČÜŅŗÖŠµÄĢ¼ĖįÄĘ£»¢ŚĢ¼ĖįĒāÄĘÓėĒāŃõ»ÆÄĘ·“Ӧɜ³ÉĢ¼ĖįÄĘŗĶĖ®£»¢ŪÓĆĒāŃõ»Æ±µ³żČ„Ć÷·ÆČÜŅŗÖŠĮņĖįøł£¬ŠčŅŖĆ÷·ÆÓėĒāŃõ»Æ±µµÄĪļÖŹµÄĮæ±ČĪŖ1:2”£
·“Ó¦ÖŠNŌŖĖŲ»ÆŗĻ¼ŪÓÉ-3¼ŪÉżøßµ½+2¼Ū£¬OŌŖĖŲ»ÆŗĻ¼ŪÓÉ0¼Ū½µµĶµ½-2¼Ū£¬·“Ó¦ÖŠO2ĪŖŃõ»Æ¼Į£¬NH3ĪŖ»¹Ō¼Į£¬µ„ĻßĒŷرķŹ¾øĆ·“Ó¦µē×Ó×ŖŅʵķ½ĻņŗĶŹżÄæĪŖ ”£±ź×¼×“æöĻĀVL°±ĘųµÄĪļÖŹµÄĮæŹĒ
”£±ź×¼×“æöĻĀVL°±ĘųµÄĪļÖŹµÄĮæŹĒ![]() £¬NŌŖĖŲ»ÆŗĻ¼ŪÓÉ-3¼ŪÉżøßµ½+2¼Ū£¬1mol°±Ęų·“Ó¦£¬×ŖŅĘ5molµē×Ó£¬Ōņ
£¬NŌŖĖŲ»ÆŗĻ¼ŪÓÉ-3¼ŪÉżøßµ½+2¼Ū£¬1mol°±Ęų·“Ó¦£¬×ŖŅĘ5molµē×Ó£¬Ōņ![]() £¬NA =4.48n/Vmol-1£»£Ø2£©øł¾ŻŃõ»Æ»¹Ō·“Ó¦¹ęĀÉ£¬ĻõĖįŹĒŅ»ÖÖ·“Ó¦Īļ£¬ŌņNOŹĒÉś³ÉĪļ£¬NŌŖĖŲ»ÆŗĻ¼Ū½µµĶ£¬ĖłŅŌNOŹĒ»¹Ō²śĪļ£¬ĮņŌŖĖŲ»ÆŗĻ¼ŪÉżøߣ¬·¢Éś·“Ó¦ŹĒH2S
£¬NA =4.48n/Vmol-1£»£Ø2£©øł¾ŻŃõ»Æ»¹Ō·“Ó¦¹ęĀÉ£¬ĻõĖįŹĒŅ»ÖÖ·“Ó¦Īļ£¬ŌņNOŹĒÉś³ÉĪļ£¬NŌŖĖŲ»ÆŗĻ¼Ū½µµĶ£¬ĖłŅŌNOŹĒ»¹Ō²śĪļ£¬ĮņŌŖĖŲ»ÆŗĻ¼ŪÉżøߣ¬·¢Éś·“Ó¦ŹĒH2S![]() S£¬ĮņŹĒŃõ»Æ²śĪļ£¬øł¾Ż·“Ó¦·½³ĢŹ½
S£¬ĮņŹĒŃõ»Æ²śĪļ£¬øł¾Ż·“Ó¦·½³ĢŹ½![]() £¬×ŖŅĘ6molµē×Ó£¬Éś³É3molS£¬Ōņ×ŖŅĘ0.3molµē×Ó£¬Éś³É0.15mol S£¬ĮņµÄÖŹĮæŹĒ4.8g”££Ø3£©¢ŁĶØČė¶žŃõ»ÆĢ¼æÉŅŌ³żČ„Ģ¼ĖįĒāÄĘČÜŅŗÖŠµÄĢ¼ĖįÄĘ£¬·“Ó¦µÄĄė×Ó·½³ĢŹ½ŹĒCO32-+ H2O+ CO2 = 2HCO3-£»¢ŚĢ¼ĖįĒāÄĘÓėĒāŃõ»ÆÄĘ·“Ӧɜ³ÉĢ¼ĖįÄĘŗĶĖ®£¬ĒāŃõ»ÆÄĘæÉŅŌ³żČ„Ģ¼ĖįÄĘČÜŅŗÖŠµÄĢ¼ĖįĒāÄĘ£»¢ŪÓĆĒāŃõ»Æ±µ³żČ„Ć÷·ÆČÜŅŗÖŠĮņĖįøł£¬ŠčŅŖĆ÷·ÆÓėĒāŃõ»Æ±µµÄĪļÖŹµÄĮæ±ČĪŖ1:2£¬·“Ó¦Ąė×Ó·½³ĢŹ½ŹĒAl3+ + 2SO42- + 4OH- + 2Ba2+ = AlO2- + 2BaSO4”ż + 2H2O”£
£¬×ŖŅĘ6molµē×Ó£¬Éś³É3molS£¬Ōņ×ŖŅĘ0.3molµē×Ó£¬Éś³É0.15mol S£¬ĮņµÄÖŹĮæŹĒ4.8g”££Ø3£©¢ŁĶØČė¶žŃõ»ÆĢ¼æÉŅŌ³żČ„Ģ¼ĖįĒāÄĘČÜŅŗÖŠµÄĢ¼ĖįÄĘ£¬·“Ó¦µÄĄė×Ó·½³ĢŹ½ŹĒCO32-+ H2O+ CO2 = 2HCO3-£»¢ŚĢ¼ĖįĒāÄĘÓėĒāŃõ»ÆÄĘ·“Ӧɜ³ÉĢ¼ĖįÄĘŗĶĖ®£¬ĒāŃõ»ÆÄĘæÉŅŌ³żČ„Ģ¼ĖįÄĘČÜŅŗÖŠµÄĢ¼ĖįĒāÄĘ£»¢ŪÓĆĒāŃõ»Æ±µ³żČ„Ć÷·ÆČÜŅŗÖŠĮņĖįøł£¬ŠčŅŖĆ÷·ÆÓėĒāŃõ»Æ±µµÄĪļÖŹµÄĮæ±ČĪŖ1:2£¬·“Ó¦Ąė×Ó·½³ĢŹ½ŹĒAl3+ + 2SO42- + 4OH- + 2Ba2+ = AlO2- + 2BaSO4”ż + 2H2O”£



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æijČÜŅŗ¾·ÖĪö£¬ĘäÖŠÖ»ŗ¬ÓŠNa+”¢K+”¢Ca2+”¢Cl©”¢NO3© £¬ ŅŃÖŖĘäÖŠK+”¢Ca2+”¢Na+”¢NO3©µÄÅØ¶Č¾łĪŖ0.1mol/L£¬ŌņCl© ĪļÖŹµÄĮæÅضČĪŖ£Ø””””£©
A.0.1 molL©1
B.0.3 molL©1
C.0.2 molL©1
D.0.4 molL©1
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÓŠ»śĪļM ÓŠæ¹¾ś×÷ÓĆ£¬ĘäŗĻ³ÉĀ·ĻßČēĻĀĶ¼ĖłŹ¾£ŗ

ŅŃÖŖ£ŗ¢Ł![]()
¢Ś
¢Ū
£Ø1£©MµÄ·Ö×ÓŹ½ŹĒ______________£¬AµÄ»ÆѧĆū³ĘŹĒ__________________”£
£Ø2£©GµÄ½į¹¹¼ņŹ½ŹĒ___________£¬FÖŠŗ¬Ńõ¹ŁÄÜĶŵÄĆū³ĘŹĒ_______________”£
£Ø3£©ÓÉAÉś³ÉBŗĶÓÉGÉś³ÉH µÄ·“Ó¦ĄąŠĶ·Ö±šŹĒ___________”¢____________”£
£Ø4£©ÓÉCÉś³ÉD µÄ»Æѧ·½³ĢŹ½ŹĒ_________________”£
£Ø5£©E µÄĶ¬·ÖŅģ¹¹ĢåÖŠ£¬·ūŗĻĻĀĮŠĢõ¼žµÄ½į¹¹¹²ÓŠ___________ÖÖ”£
¢Ł±½µÄ¶žŌŖČ”“śĪļ ¢ŚÓėE ¾ßÓŠĻąĶ¬µÄ¹ŁÄÜĶÅ ¢ŪÄÜ·¢ÉśŅų¾µ·“Ó¦ŗĶĖ®½ā·“Ó¦
£Ø6£©½įŗĻĢāøųŠÅĻ¢£¬ŅŌ¼×±½ĪŖŌĮĻÖʱø»ÆŗĻĪļ![]() £¬Éč¼ĘŗĻ³ÉĀ·ĻߣØĘäĖūŹŌ¼ĮČĪŃ”£©”£ _________
£¬Éč¼ĘŗĻ³ÉĀ·ĻߣØĘäĖūŹŌ¼ĮČĪŃ”£©”£ _________
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ°±ŗĶėĀ(N2H4)¶¼ŹĒµŖŌŖĖŲµÄÖŲŅŖĒā»ÆĪļ£¬ŌŚ¹¤Å©ŅµÉś²ś”¢Éś»īÖŠÓŠ¹ć·ŗÓ¦ÓĆ”£
£Ø1£©¹¤ŅµÖŠ³£ÓĆŅŌĻĀ·“Ó¦ŗĻ³É°±£ŗN2+3H2![]() 2NH3 ”÷H£¼0”£Ä³ŹµŃéŹŅŌŚČżøö²»Ķ¬Ģõ¼žµÄĆܱÕČŻĘ÷ÖŠ£¬·Ö±š¼ÓČėÅØ¶Č¾łĪŖc£ØN2£©=0.100mol/L£¬c£ØH2£©=0.300mol/L½ųŠŠ·“Ó¦Ź±£¬N2µÄÅضČĖꏱ¼äµÄ±ä»ÆČēĻĀĶ¼¢Ł”¢¢Ś”¢¢ŪĒśĻßĖłŹ¾£ŗ
2NH3 ”÷H£¼0”£Ä³ŹµŃéŹŅŌŚČżøö²»Ķ¬Ģõ¼žµÄĆܱÕČŻĘ÷ÖŠ£¬·Ö±š¼ÓČėÅØ¶Č¾łĪŖc£ØN2£©=0.100mol/L£¬c£ØH2£©=0.300mol/L½ųŠŠ·“Ó¦Ź±£¬N2µÄÅضČĖꏱ¼äµÄ±ä»ÆČēĻĀĶ¼¢Ł”¢¢Ś”¢¢ŪĒśĻßĖłŹ¾£ŗ
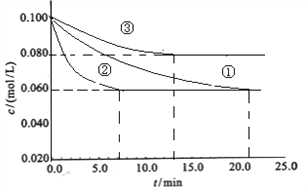
×°ĮD¢Ū½öÓŠŅ»øö·“Ó¦Ģõ¼žÓė¢Ł²»Ķ¬£¬øĆĢõ¼žĪŖ_______________£¬ŹµŃé¢ŚĘ½ŗāŹ±H2µÄ×Ŗ»ÆĀŹĪŖ_____________£»
£Ø2£©ėĀŹĒŅ»ÖÖ¾ßÓŠĒ滹ŌŠŌµÄĪŽÉ«ÓĶדŅŗĢ壬æÉÓĆ×÷Č¼ĮĻ”£
¢ŁŌŚ»š¼żĶĘ½ųĘ÷֊װӊėŻ(N2H4)ŗĶŅŗĢ¬H2O2£¬ŅŃÖŖ0.4molŅŗĢ¬N2H4ŗĶ×ćĮæŅŗĢ¬H2O2·“Ó¦£¬Éś³ÉĘųĢ¬N2ŗĶĘųĢ¬H2O£¬·Å³ö256.6kJµÄČČĮ攣øĆ·“Ó¦µÄČČ»Æѧ·½³ĢŹ½ĪŖ_____________________________________________________”£
¢ŚėĀ(N2H4)-æÕĘųČ¼ĮĻµē³ŲŹĒŅ»ÖÖ»·±£ŠĶ¼īŠŌČ¼ĮĻµē³Ų£¬µē½āÖŹČÜŅŗŹĒ20%-30%µÄKOHČÜŅŗ”£ŅŃÖŖėĀŌŚ101kPa”¢25”ęĢõ¼žĻĀµÄČ¼ÉÕČČĪŖ624kJ”¤mol-1£¬Čē¹ū“ĖČ¼ĮĻµē³ŲµÄÄÜĮæ×Ŗ»ÆĀŹĪŖ50%£¬µ±ĻūŗÄæÕĘų2.24L£ØŅŃÕŪĖćĪŖ±ź×¼×“æöĻĀĢå»ż£©Ź±£¬Ōņ“Ėµē³Ų²śÉśµÄµēÄÜŌ¼ĪŖ_________kJ”££Ø¼ŁÉčæÕĘųÖŠŃõĘųµÄĢå»żŗ¬ĮæĪŖ20%£¬²śĪļĪŖŅŗĢ¬Ė®£©

£Ø3£©ėĀÓÖ³Ę”°ĮŖ°±”±£¬ĪŖ¶žŌŖČõ¼ī£¬ŌŚĖ®ÖŠµÄµēĄė·½³ĢŹ½Óė°±ĻąĖĘ£¬ėĀµŚŅ»²½µēĄė·“Ó¦µÄĘ½ŗā³£ŹżÖµĪŖ____________.£ØŅŃÖŖ£ŗN2H4+H+![]() N2H5+ µÄK=8.7”Į107£»KW =1.0”Į10-14£©
N2H5+ µÄK=8.7”Į107£»KW =1.0”Į10-14£©
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æijŠ”×éĪŖŃŠ¾æµē»ÆѧŌĄķ£¬Éč¼ĘČēĶ¼×°ÖĆ”£ĻĀĮŠŠšŹö²»ÕżČ·µÄŹĒ
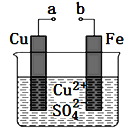
A. aŗĶb²»Į¬½ÓŹ±£¬ĢśĘ¬ÉĻ»įÓŠ½šŹōĶĪö³ö
B. aŗĶbÓƵ¼ĻßĮ¬½ÓŹ±£¬ĶʬÉĻ·¢ÉśµÄ·“Ó¦ĪŖ£ŗCu2£«£«2e££½Cu
C. ĪŽĀŪaŗĶbŹĒ·ńĮ¬½Ó£¬ĢśĘ¬¾ł»įČܽā£¬ČÜŅŗ“ÓĄ¶É«Öš½„±ä³ÉĒ³ĀĢÉ«
D. aŗĶbĻąĮ¬¹¹³ÉŌµē³Ų£¬µē×ÓÓÉaĮ÷Ļņb
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æijÖŲŅŖÓŠ»śŗĻ³ÉÖŠ¼äĢåXµÄ½į¹¹ČēĶ¼ĖłŹ¾£¬ÓŠ¹ŲøĆĪļÖŹµÄĖµ·ØÕżČ·µÄŹĒ

A. X·Ö×ÓÖŠĖłÓŠĢ¼Ō×ÓŅ»¶Ø¹²Ćę
B. XæÉŅŌŹ¹äåĖ®”¢ĖįŠŌKMnO4ĶŹÉ«£¬ĒŅŌĄķ²»ĻąĶ¬
C. ±źæöĻĀ1 molX·Ö±šŗĶ×ćĮæNaŗĶNaHCO3·“Ó¦£¬Éś³ÉĘųĢåĢå»żĻąĶ¬
D. XÓėøż¶žĖį£Ø![]() £©»„ĪŖĶ¬·ÖŅģ¹¹Ģå
£©»„ĪŖĶ¬·ÖŅģ¹¹Ģå
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻņŗ¬ÓŠKI”¢NaBrµÄ»ģŗĻČÜŅŗÖŠĶØČė¹żĮæµÄCl2³ä·Ö·“Ó¦£®½«ČÜŅŗÕōøɲ¢×ĘÉÕ£¬×īŗóŹ£ÓąµÄ¹ĢĢåĪļÖŹŹĒ£Ø””””£©
A.KIŗĶNaBr
B.KClŗĶNaCl
C.KClŗĶNaBr
D.KCl”¢NaClŗĶI2
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÓĆNaOH±ź×¼ČÜŅŗµĪ¶ØĪ“ÖŖÅØ¶ČµÄŃĪĖį£¬ÓĆ·ÓĢŖĪŖÖøŹ¾¼Į£¬Ōģ³É²ā¶Ø½į¹ūĘ«øßµÄŌŅņæÉÄÜŹĒ
A. ÅäÖʱź×¼ČÜŅŗµÄNaOHÖŠ»ģÓŠNa2CO3 ŌÓÖŹ
B. Ź¢×°“ż²āŅŗµÄ׶ŠĪĘæÓĆŃąĮóĖ®Ļ“¹ż£¬Ć»ÓŠÓĆ“ż²āŅŗĻ“
C. µĪ¶Øµ½ÖÕµć¶ĮŹżŹ±£¬ø©ŹÓæĢ¶ČĻß
D. µĪ¶Øµ½ÖÕµć¶ĮŹżŹ±£¬µĪ¶Ø¹Ü¼ā×ģ“¦ÓŠĘųÅŻ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”潫V1mL1.00mol”¤L-1HClČÜŅŗŗĶV2mLĪ“ČēÅØ¶ČµÄNaOHČÜŅŗ»ģŗĻ¾łŌČŗó²āĮæ²¢¼ĒĀ¼ČÜŅŗĪĀ¶Č£¬ŹµŃé½į¹ūČēĶ¼ĖłŹ¾(ŹµŃéÖŠŹ¼ÖÕ±£³ÖV1+V2=50mL)”£ĻĀĮŠŠšŹöÕżČ·µÄŹĒ£Ø £©

A. ×öøĆŹµŃ鏱»·¾³ĪĀ¶ČĪŖ22”ę B. øĆŹµŃé±ķĆ÷»ÆѧÄÜæÉŅŌ×Ŗ»ÆĪŖČČÄÜ
C. NaOHČÜŅŗµÄÅضČŌ¼ĪŖ1.00mol”¤L-1 D. øĆŹµŃé±ķĆ÷ÓŠĖ®Éś³ÉµÄ·“Ó¦¶¼ŹĒ·ÅČČ·“Ó¦
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com