
| A. | Z>X>Y | B. | X>Y>Z | C. | Z>Y>X | D. | X>Z>Y |
科目:高中化学 来源: 题型:选择题
| A. | 氯气与水反应:Cl2+H2O=2H++Cl-+ClO- | |
| B. | 碳酸氢钙溶液加到盐酸中:Ca(HCO3)2+2HCl=Ca2++2CO2↑+2H2O | |
| C. | 少量金属钠加到冷水中:Na+2H2O=Na++OH-+H2↑ | |
| D. | 氢氧化铜加到盐酸中:Cu(OH)2+2H+=Cu2++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑥⑦ | B. | ②③⑤⑦ | C. | ①③④⑤ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤⑧⑨ | B. | ②④⑤⑦⑨ | C. | ①③⑥⑧⑨ | D. | ③⑤⑥⑦⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | H-H | H-F | H-Cl | H-Br |
| 键能/kJ/mol | 436 | 565 | 431 | 368 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤ | B. | ⑤④③②① | C. | ③④⑤①② | D. | ②①⑤④③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 充分加热至沸腾 | B. | 加入乙醛太少 | ||
| C. | 加入NaOH溶液的量不够 | D. | 加入CuSO4溶液的量不够 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C3N4晶体是原子晶体 | |
| B. | C3N4晶体中,C-N键的键长比金刚石中的C-C键的键长要短 | |
| C. | C3N4晶体中每个C原子连接4个N原子,而每个N原子连接3个C原子 | |
| D. | C3N4晶体中微粒间通过离子键结合 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
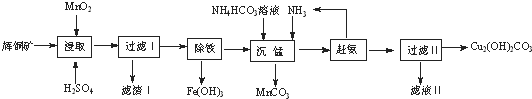
| 开始沉淀的pH | 沉淀完全的pH | |
| Fe3+ | 1.1 | 3.2 |
| Mg2+ | 8.3 | 9.8 |
| Cu2+ | 4.4 | 6.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com