
(1)NaBH4极易溶解于水,并与水反应产生H2,反应后硼以![]() 形式存在,写出反应的离子方程式___________________________________。
形式存在,写出反应的离子方程式___________________________________。
(2)溶液的酸性越强,NaBH4与水的反应速率越______________ (填“快”或“慢”)。
(3)NaBH4可使许多金属离子还原为金属原子,例如可使含有金离子(Au3+) 的废液中的Au3+还原,其反应的离子方程式是_________________________________________________。
解析:本题根据信息书写离子方程式,是考查学生自学能力很好的题型,它既能看出学生对所学知识的掌握程度,又能体现学生接受新知识的能力。根据题给信息,NaBH4是还原剂,且与水反应产生H2,反应后硼以![]() 形式存在,不难推知水是氧化刘,沿着这条思路可写出:
形式存在,不难推知水是氧化刘,沿着这条思路可写出:![]() +2H2O====
+2H2O====![]() +4H2↑。
+4H2↑。
再根据(1)中可知,水是氧化剂,且电离出来的氢离子浓度小,若c(H+)大,可加快反应速率。由(1)和(2)的回答可知,在中性或酸性溶液中,![]() 与H2O能剧烈反应,为了抑制它们之间的反应,促使
与H2O能剧烈反应,为了抑制它们之间的反应,促使![]() 与Au3+反应,显而易见,只有在碱性条件下进行。即
与Au3+反应,显而易见,只有在碱性条件下进行。即
8Au3++![]() +24 OH-====8Au+
+24 OH-====8Au+![]() +18H2O,
+18H2O,
注意不要错写成:8Au3++![]() +9H2O====8Au+3H3BO3+21 OH-。
+9H2O====8Au+3H3BO3+21 OH-。
答案:(1) ![]() +2H2O====
+2H2O====![]() +4H2↑ (2)快
+4H2↑ (2)快
(3)8Au3++![]() +24 OH-====8Au+
+24 OH-====8Au+![]() +18H2O
+18H2O


科目:高中化学 来源: 题型:
(1)NaBH4极易溶解于水并与水作用产生H2,反应后硼元素以![]() 形式存在于溶液中,此反应的离子方程式为______________________________________________________。
形式存在于溶液中,此反应的离子方程式为______________________________________________________。
(2)该反应与溶液酸碱度有关,pH越小,反应速率越____________,其原因是__________________________。
(3)NaBH4可使许多金属离子还原为金属单质,例如它们可以使含有金离子(Au3+)的废液中Au3+还原(碱性条件,此时硼仍以![]() 形式存在),离子方程式__________________________。
形式存在),离子方程式__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在有机化学工业中常用的一种钠盐是NaBH4,即硼氢化钠。它具有很强的还原性,也是一种高贮氢密度材料,是最有可能作为氢燃料电池的即时供应氢源。但它不能与水和酸共存。
⑴将其投入水中可生成偏硼酸钠(NaBO2)和氢气,写出该反应的化学方程式 ,反应中的还原剂是 ,每摩NaBH4反应时电子转移数为 mol。
⑵若将NaBH4投入酸溶液中其反应速率与其放入水中相比,应快还是慢 ,理由是 。
⑶NaBH4还用于将含Au3+的碱性废液中回收黄金,其离子方程式为:
![]()
请写出配平的离子方程式 。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年浙江省杭州市高三上学期10月考化学试卷 题型:填空题
(6分)在有机化学工业中常用的一种钠盐是NaBH4,即硼氢化钠。它具有很强的还原性,也是一种高贮氢密度材料,是最有可能作为氢燃料电池的即时供应氢源。但它不能与水和酸共存。⑴将其投入水中可生成偏硼酸钠(NaBO2)和氢气,写出该反应的化学方程式 ,反应中的还原剂是 ,每摩NaBH4反应时电子转移数为 mol。
⑵NaBH4还用于将含Au3+的碱性废液中回收黄金,其离子方程式为:
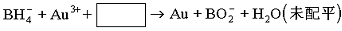
请写出配平的离子方程式 。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年浙江省高三10月月考化学试卷 题型:填空题
在有机化学工业中常用的一种钠盐是NaBH4,即硼氢化钠。它具有很强的还原性,也是一种高贮氢密度材料,是最有可能作为氢燃料电池的即时供应氢源。但它不能与水和酸共存。
⑴将其投入水中可生成偏硼酸钠(NaBO2)和氢气,写出该反应的化学方程式 ,反应中的还原剂是 ,每摩NaBH4反应时电子转移数为 mol。
⑵若将NaBH4投入酸溶液中其反应速率与其放入水中相比,应快还是慢 ,理由是 。
⑶NaBH4还用于将含Au3+的碱性废液中回收黄金,其离子方程式为:
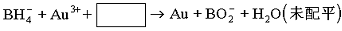
请写出配平的离子方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com