
卤族元素是典型的非金属元素,包括F、Cl、Br、I等。请回答下面有关问题
(1)同主族元素的电负性大小存在一定的规律,卤族元素F、Cl、Br、I的电负性由小到大的顺序是_____。
(2)Br原子的核外电子排布式为_________。
(3)用价层电子对互斥理论判断BeCl2的构型为________,BF3分子中B-F键的键角为________。
(4)CCl4分子中碳原子的杂化方式为________,NF3分子的空间构型为________。
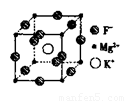
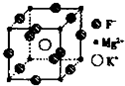
(5)F、Mg、K三种元素形成的晶体晶胞结构如图所示,一个晶胞中 Mg元素的质量分数为________。
(8分)(1)I<Br<Cl<F(1分) (2)1s22s22p63s23p63d104s24p5或[Ar]3d104s24p5(1分)
(3)直线型(1分);120°(1分) (4)sp3(1分);三角锥形(1分) (5)20%(2分)
【解析】
试题分析:(1)非金属性越强,电负性越强。同主族自上而下非金属性逐渐减弱,因此电负性减弱,故卤族元素F、Cl、Br、I的电负性由小到大的顺序是I<Br<Cl<F。
(2)Br元素的原子序数是35,则根据构造原理可知,其原子的核外电子排布式为1s22s22p63s23p63d104s24p5或[Ar]3d104s24p5。
(3)根据价层电子对互斥理论可知,BeCl2中Be含有的孤对电子对数=(2-2×1)÷2=0,所以BeCl2是直线型结构,BF3分子的中心原子B原子含有的孤对电子对数=(3-3×1)÷2=0,Be原子上含有3个σ键,所以BF3分子的VSEPR模型是平面三角型,中心原子上没有孤对电子,所以其空间构型就是平面三角形,键角是120°。
(4)CCl4中碳原子含有的孤对电子对数=(4-4×1)÷2=0,因此四氯化碳是正四面体型结构,碳原子和氯原子均形成四个单键,故其为sp3杂化;NF3分子中N原子含有的孤对电子对数=(5-3×1)÷2=1,所以其构型与NH3相似,都是三角锥型的。
(5)根据晶胞结构并依据均摊法可知,该晶胞中含有镁原子个数=8×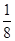 =1个,钾原子个数=1,氟原子个数=12×
=1个,钾原子个数=1,氟原子个数=12× =3,所以其化学式为KMgF3,因此该化合物中镁元素的质量分数=
=3,所以其化学式为KMgF3,因此该化合物中镁元素的质量分数= ×100%=20%。
×100%=20%。
考点:考查元素电负性、原子核外电子排布、分子或离子的构型、杂化类型判断以及晶胞的计算等


科目:高中化学 来源: 题型:
 卤族元素是典型的非金属元素,包括F、Cl、Br、I等.请回答下面有关问题
卤族元素是典型的非金属元素,包括F、Cl、Br、I等.请回答下面有关问题查看答案和解析>>
科目:高中化学 来源:高一化学 第一章 物质结构 元素周期律 单元质量评估(一) B卷(人教版必修2)(教师专用) 题型:013
|
关于卤族元素的下列叙述中正确的是 | |
| [ ] | |
A. |
卤族元素是典型的非金属元素,因此不能与其他非金属元素反应 |
B. |
卤族元素单质越活泼,其熔点和沸点就越高 |
C. |
卤族元素单质都能与水剧烈反应 |
D. |
卤族元素单质都能和氢气反应,且生成的气态氢化物的稳定性随单质氧化性的增强而增强 |
查看答案和解析>>
科目:高中化学 来源:2013届四川省高一下学期期中考试化学试卷 题型:选择题
下列叙述中正确的是
A.卤族元素是典型的非金属元素,因此不能与其他非金属元素反应
B.碱金属元素单质越活泼,其熔点和沸点就越高
C.卤族元素单质都能与水剧烈反应
D.卤族元素单质都能和氢气反应,且气态氢化物的稳定性随单质氧化性的增强而增强
查看答案和解析>>
科目:高中化学 来源:模拟题 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com