
【题目】二氧化铈(CeO2)是一种重要的稀土氧化物,平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2、FeO等物质)。某课题组以此粉末为原料,设计如下工艺流程对资源进行回收,得到纯净的CeO2和硫酸铁铵晶体。
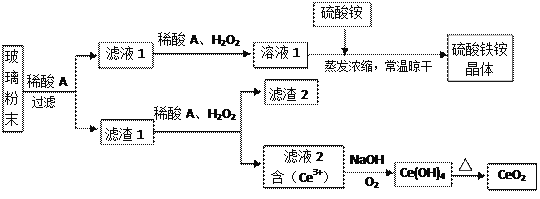
已知:CeO2不溶于稀硫酸,也不溶于NaOH溶液。
(1)稀酸A的分子式是___________________。
(2)滤液1中加入H2O2溶液的目的是_________________________________________________。
(3)某同学设计实验证明滤液1中含有Fe2+,他所用的试剂为___________________。
(4)已知溶液中的Fe2+可以和难溶于水的FeO(OH)反应生成Fe3O4,请书写该反应的离子方程式_____________________________________________________________________________。
(5)由滤液2生成Ce(OH)4的离子方程式______________________________________________。
(6)硫酸铁铵晶体[Fe2(SO4)3·2(NH4)2SO4·3H2O]广泛用于水的净化处理。相对于去除中性废水,其在去除酸性废水中的悬浮物时效率_________(填“增强”或“降低”)。
(7)取上述流程中得到的Ce(OH)4产品0.531 g,加硫酸溶解后,用浓度为0.l000mol·L-1FeSO 4标准溶液滴定至终点时(铈被还原为Ce3+ ),消耗25.00 mL标准溶液。
该产品中Ce(OH)4的纯度为__________________。(保留两位有效数字)
【答案】 H2SO4 使Fe2+氧化为Fe3+ 铁氰化钾溶液(或高锰酸钾溶液) Fe2+ +2FeO(OH)=Fe3O4 +2H+ 4Ce 3 ++ O2 +12OH-+2H2O ==4 Ce(OH)4↓ 降低 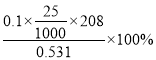 =98%(或0.98)
=98%(或0.98)
【解析】(1)根据流程中后面出现的硫酸盐,可推出稀酸A为稀硫酸,其分子式是:H2SO4;(2)根据后面所得产品为硫酸铁铵晶体,铁应该为+3价,而废玻璃粉末中含有氧化铁和氧化亚铁,滤液1中加入H2O2溶液的目的是使Fe2+氧化为Fe3+,以免产品不纯;(3)滤液1中含有铁离子,若要检验其中还含有Fe2+,必须利用亚铁离子具有的性质进行检验,而不能再利用氧化剂和KSCN溶液进行检验,所用试剂可以为:铁氰化钾溶液或高锰酸钾溶液;(4)根据质量守恒和电荷守恒可得:Fe2+和难溶于水的FeO(OH)反应生成Fe3O4的离子方程式为:Fe2+ +2FeO(OH)=Fe3O4 +2H+;(5)滤液2 Ce 3 +在碱性条件下与被氧气氧化生成Ce(OH)4沉淀的离子方程式为:4Ce3 ++ O2 +12OH-+2H2O =4 Ce(OH)4↓;(6)硫酸铁铵晶体用于水的净化处理是利用铁离子水解产生氢氧化铁胶体,吸附水中的悬浮物,酸性废水中氢离子抑制铁离子的水解,故在去除酸性中的悬浮物时效率降低;(7)根据电子守恒Ce从+4价变为+3价,铁由+2价变为+3价,则建立关系式:Ce(OH)4~FeSO4,设该产品中Ce(OH)4的纯度为x,则:
Ce(OH)4~FeSO4
1 1
![]() 0.1000mol/L×0.025L,
0.1000mol/L×0.025L,
解得:x=![]() =0.98=98%。
=0.98=98%。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】用5mL的0.2 mol·L—1 BaCl2溶液恰好可使相同体积的Fe2(SO4)3、ZnSO4和K2SO4三种溶液中的硫酸根离子完全转化沉淀,则三种硫酸盐溶液物质的量浓度之比是( )
A. 3:2:1 B. 1:2:3 C. 1:3:3 D. 3:1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列与金属腐蚀有关的说法正确的是( ) 
A.图a中,插入海水中的铁棒,越靠近底端腐蚀越严重
B.图b中,开关由M改置于N时,Cu﹣Zn合金的腐蚀速率减小
C.图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大
D.图d中,Zn﹣MnO2干电池自放电腐蚀主要是由MnO2的氧化作用引起的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在常温常压时,充分燃烧一定量的丁烷(C4H10)气体,放出热量Q kJ(Q>0),将生成的二氧化碳全部通入足量NaOH溶液中,发生的反应为:CO2+2NaOH=Na2CO3+H2O,共消耗了4molL﹣1的NaOH溶液200mL.则此条件下,下列热化学方程式正确的是( )
A.C4H10(g)+ ![]() O2(g)═4CO2(g)+5H2O(l)△H=﹣Q kJ?mol﹣1
O2(g)═4CO2(g)+5H2O(l)△H=﹣Q kJ?mol﹣1
B.C4H10(g)+ ![]() O2(g)═4CO2(g)+5H2O(l)△H=﹣10Q kJ?mol﹣1
O2(g)═4CO2(g)+5H2O(l)△H=﹣10Q kJ?mol﹣1
C.C4H10(g)+ ![]() O2(g)═4CO2(g)+5H2O(l)△H=+10Q kJ?mol﹣1
O2(g)═4CO2(g)+5H2O(l)△H=+10Q kJ?mol﹣1
D.C4H10(g)+ ![]() O2(g)═4CO2(g)+5H2O(g)△H=﹣10Q kJ
O2(g)═4CO2(g)+5H2O(g)△H=﹣10Q kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用一种阴、阳离子双隔膜三室电解槽处理废水中的NH4+ , 模拟装置如图所示.下列说法正确的是( ) 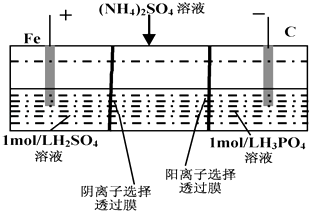
A.阳极室溶液由无色变成棕黄色
B.阴极的电极反应式为:4OH﹣﹣4e﹣=2H2O+O2↑
C.电解一段时间后,阴极室溶液中的酸性减弱
D.电解一段时间后,阴极室溶液中的溶质一定是(NH4)3PO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E五种短周期元素,元素A的一种原子无中子,元素B和C都有2个电子层,它们能生成无色无嗅的气体BC2 , 元素D有三个电子层,它和元素C属于同一主族,D和C生成有刺激性气味的气体DC2;元素E的阳离子E+的电子层结构与Ne的电子层结构相同,试回答:
(1)它们的元素名称是:ABCDE .
(2)A与B的化合物以键结合,写出BA4的电子式;
C和E的化合物以键结合,写出E2C的电子式;
(3)A、B、C、E的原子半径从大到小的顺序为(写元素符号);
(4)写出A和C的化合物(A2C)与C和E的化合物(E2C2)反应的化学方程式:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com