
| A. | 微粒半径:Mg2+>F- | B. | 稳定性:HI>HBr | ||
| C. | 酸性:H2CO3>H3PO4 | D. | 熔点:Al>Na |
分析 A.具有相同电子排布的离子,原子序数大的离子半径小;
B.非金属性越强,气态氢化物越稳定;
C.非金属性越强,最高价氧化物对应水化物的酸性越强;
D.金属的半径越小,电荷越大,则熔点越高.
解答 解:A.具有相同电子排布的离子,原子序数大的离子半径小,则微粒半径:Mg2+<F-,故A错误;
B.非金属性Br>I,气态氢化物的稳定性为HI<HBr,故B错误;
C.非金属性P>C,最高价氧化物对应水化物的酸性为H2CO3<H3PO4,故C错误;
D.金属的半径越小,电荷越大,则熔点越高,则熔点:Al>Na,故D正确;
故选D.
点评 本题考查元素周期表和元素周期律的综合应用,为高频考点,把握元素的性质比较、元素周期律的应用为解答的关键,侧重规律性知识的考查,题目难度不大.


 全能测控一本好卷系列答案
全能测控一本好卷系列答案科目:高中化学 来源: 题型:解答题
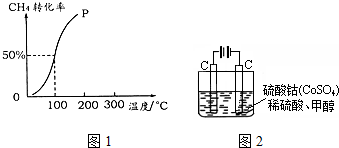
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 英国科学家近日研发出一种名为NOTT-202a的新型多孔材料,空气中其他气体可自由通过这些空洞,但CO2会被截留.该材料的分子结构单元是以铟原子为中心,周围是以各种有机分子链条编织的“笼子”,整体上看呈现多孔特征,有些类似自然界中的蜂窝结构,下列有关说法正确的是( )
英国科学家近日研发出一种名为NOTT-202a的新型多孔材料,空气中其他气体可自由通过这些空洞,但CO2会被截留.该材料的分子结构单元是以铟原子为中心,周围是以各种有机分子链条编织的“笼子”,整体上看呈现多孔特征,有些类似自然界中的蜂窝结构,下列有关说法正确的是( )| A. | 该材料完全由金属元素构成 | |
| B. | 该材料能捕集CO2,是因为该材料可以选择性吸收CO2 | |
| C. | 该材料捕集11.2LCO2后,增重22g | |
| D. | 可利用该材料将空气中的CO2,完全捕集,从而控制温室效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相对分子质量相同,结构不同的化合物互为同分异构体 | |
| B. | 同分异构体间的相互转化不存在能量的变化 | |
| C. | C4H10的一氯代物共2种结构 | |
| D. | 甲苯( )苯环上的氢原子被一个氯原子取代后的产物共有3种 )苯环上的氢原子被一个氯原子取代后的产物共有3种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
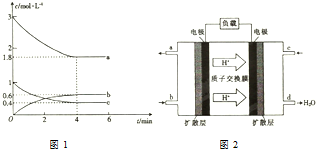 甲醇是一种低碳能源,在全球能源危机和环境污染的背景下具有良好的发展前景,在催化剂作用下可用H2(g)+CO(g)$\stackrel{催化剂}{?}$CH3OH(g),三种物质的物质的量浓度随时间变化的关系如图1所示.
甲醇是一种低碳能源,在全球能源危机和环境污染的背景下具有良好的发展前景,在催化剂作用下可用H2(g)+CO(g)$\stackrel{催化剂}{?}$CH3OH(g),三种物质的物质的量浓度随时间变化的关系如图1所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
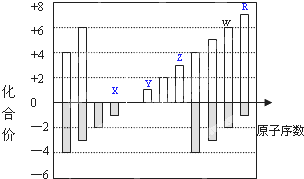 如图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( )
如图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( )| A. | Y和Z两者最高价氧化物对应的水化物能相互反应 | |
| B. | 气态氢化物的稳定性:W>R | |
| C. | WO3和水反应形成的化合物是离子化合物 | |
| D. | 原子半径:Z>Y>X |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com