
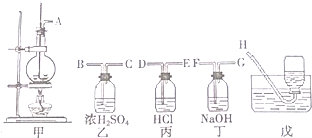
分析 (1)乙醇和浓硫酸反应制取的乙烯中含有二氧化硫,可以通过盛有氢氧化钠的洗气瓶洗气,然后用排水法收集;
(2)乙醇在浓硫酸催化剂、脱水剂条件下加热到170度发生消去反应生成乙烯;
(3)二氧化硫是否存在可用品红溶液检验;检验乙烯可以用溴水或高锰酸钾酸性溶液;乙烯和二氧化硫都能使溴水或高锰酸钾酸性溶液褪色;
(4)乙醇中含有羟基,羟基为亲水基团.
解答 解:(1)乙醇和浓硫酸反应制取的乙烯中含有二氧化硫,可以通过盛有氢氧化钠的洗气瓶洗气,然后用排水法收集,正确的连接顺序为:AFGH;
故答案为:AFGH;
(2)乙醇消去生成乙烯方程式:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O;属于消去反应;
故答案为:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O;消去反应;
(3)乙烯不与NaOH溶液反应,但二氧化硫能与碱反应(SO2+2NaOH=Na2SO3+H2O),二氧化硫是否存在可用品红溶液检验,乙烯的检验应放在排除SO2的干扰后进行,选通过品红溶液褪色检验SO2的存在;再通过NaOH溶液除去SO2,再通过品红溶液不褪色确认SO2已除干净.最后用高锰酸钾酸性溶液褪色实验检验乙烯,
故答案为:A;B;A;D;
(4)乙醇中含有羟基,羟基为亲水基团,所以乙醇易溶于水;
故答案为:能;因为乙醇中含有羟基,羟基是亲水基团.
点评 本题考查乙烯的化学性质、制备以及常见气体的检验,熟悉乙醇、乙烯、二氧化硫的性质是解题关键,题目难度不大.


 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案科目:高中化学 来源: 题型:选择题
 >H2CO3>
>H2CO3> >HCO${\;}_{3}^{-}$,现将
>HCO${\;}_{3}^{-}$,现将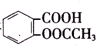 转变为
转变为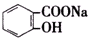 ,可行的方法是( )
,可行的方法是( )| A. | 向该溶液中加入足量的稀硫酸,加热 | |
| B. | 将该物质与稀硫酸共热后,再加入足量的NaOH溶液 | |
| C. | 将该物质与稀硫酸共热后,再加入足量的Na2CO3溶液 | |
| D. | 将该物质与足量的NaOH溶液共热,再通入足量CO2气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 Y、z为同周期金属元素,Y、Z的最高价氧化物对应水化物可以反应生成盐和水.回答下列问题:
Y、z为同周期金属元素,Y、Z的最高价氧化物对应水化物可以反应生成盐和水.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 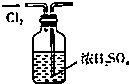 干燥Cl2 干燥Cl2 | B. |  吸收HCl | C. | 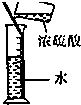 稀释浓H2SO4 | D. | 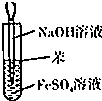 制取Fe(OH)2沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 木糖醇与核糖(C3H10O3)互为同分异构体 | |
| B. | 木糖醇与甘油(CH2OHCHOHCH2OH)互为同系物 | |
| C. | 木糖醇可以与乙酸发生酯化反应 | |
| D. | 木糖醇与葡萄一样是一种单糖 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题



 ,其反应类型是消去反应.
,其反应类型是消去反应. .
.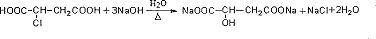 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③④ | B. | ②④ | C. | ②⑤ | D. | ①⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 70 | 66 |
| 主要化合价 | +2 | +3 | +3、+5、-3 | -2 |
| A. | X、Y元素的金属性:X<Y | |
| B. | 一定条件下,Z单质与W的常见单质直接生成ZW2 | |
| C. | Y的最高价氧化物对应的水化物能溶于稀氨水 | |
| D. | 一定条件下,W单质可以和Z的氢化物反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n(SO2)/mol | 2.00 | 0.60 | |||
| n(SO3)/mol | 0.00 | 0.80 | 1.8 | 1.8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com