
| A. | 3.2g铜与足量稀硝酸反应过程中转移电子0.1NA | |
| B. | 35.5g超氧化钾(KO2)所含的阴离子的数目为NA | |
| C. | 标准状况下将0.5molSO2气体与0.5molH2S气体混合后,气体的分子总数为NA | |
| D. | 6g二氧化硅中含Si-O键数为0.2NA |
分析 A、铜与硝酸反应生成硝酸铜,铜由0价升高为+2价,根据n=$\frac{m}{M}$计算铜的物质的量,再根据N=nNA计算转移电子数目;
B、超氧化钾是超氧根离子和钾离子构成,依据n=$\frac{m}{M}$计算物质的量计算阴离子数分析;
C、二氧化硫和硫化氢混合后发生反应生成硫单质和水;
D、依据n=$\frac{m}{M}$计算物质的量,结合二氧化硅所含化学键为4个Si-O键计算.
解答 解:A、铜与硝酸反应生成硝酸铜,铜由0价升高为+2价,3.2g铜与足量硝酸完全溶解时,电子转移数为$\frac{3.2g}{64g/mol}$×2×NAmol-1=0.1NA,故A正确;
B、超氧化钾是超氧根离子和钾离子构成,35.5g超氧化钾(KO2)物质的量=$\frac{35.5g}{71g/mol}$=0.5mol,所含的阴离子的数目为0.5NA,故B错误;
C、标准状况下将0.5molSO2气体与0.5molH2S气体混合后,SO2+2H2S=3S↓+2H2O,硫化氢全部反应,剩余二氧化硫0.25mol,气体的分子总数为0.25NA,故C错误;
D、6g二氧化硅物质的量=$\frac{6g}{60g/mol}$=0.1mol,二氧化硅所含化学键为4个Si-O键,6g二氧化硅含有Si-O键数目为0.4NA,故D错误;
故选A.
点评 本题考查常用化学计量数的有关计算,物质结构和性质的理解应用,难度不大,注意A中铜完全反应,转移电子数与硝酸的浓度无关.


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:解答题

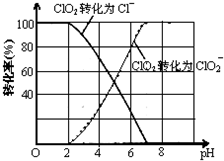
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
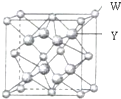 X、Y、Z、W四种元素分别位于周期表中三个紧邻的周期,且原子序数逐渐增大,X和Y的氢化物都比同族下一周期元素氢化物的沸点高,但在同周期中却不是最高的.Z是同周期元素中离子半径最小的元素.W原子的价电子层上有两个运动状态不同的电子.请回答下列问题:
X、Y、Z、W四种元素分别位于周期表中三个紧邻的周期,且原子序数逐渐增大,X和Y的氢化物都比同族下一周期元素氢化物的沸点高,但在同周期中却不是最高的.Z是同周期元素中离子半径最小的元素.W原子的价电子层上有两个运动状态不同的电子.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 冰融化一一共价键 | B. | 氢氧化钠熔融--离子键、共价键 | ||
| C. | 氯化氢溶于水--范德华力 | D. | 硫酸氢钠溶于水--离子键、共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 卤族单质,随着相对分子量的增大,分子间作用力增强,熔沸点也相应升高 | |
| B. | 元素周期表有7个主族,7个副族,1个0族,1个Ⅷ族,共16个纵行 | |
| C. | 砹(At)为有色固体,AgAt难溶于水也不溶于稀硝酸 | |
| D. | 在氧气中,铷(Rb)的燃烧产物比钠的燃烧产物更复杂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钙的元素符号:Ca | B. | 硫离子结构示意图: | ||
| C. | 二氧化碳的结构式 O=C=O | D. | NaCl的电子式: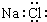 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径 B>D>C | |
| B. | 原子序数 d>c>a | |
| C. | 离子半径 C>D>B | |
| D. | 原子结构的最外层电子数目 B>D>C |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
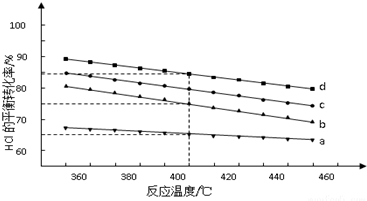
.

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ⅠA元素的电负性从上到下逐渐减小,ⅦA元素的第一电离能从上到下逐渐减小 | |
| B. | 电负性的大小可以作为衡量元素的金属性和非金属性强弱的尺度 | |
| C. | 氢原子中只有一个电子,故氢原子只有一个原子轨道 | |
| D. | NaH的存在能支持可将氢元素放在ⅦA的观点 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com