

 .
.分析 (1)依据质量换算物质的量,结合化学方程式对应的物质的量计算反应放出的热量,依据热化学方程式书写方法,标注物质聚集状态和反应焓变写出;
(2)由盖斯定律可知$\frac{1}{2}$(①+②)得CH4(g)+2O2(g)=CO2(g)+2H2O (l)△H;
(3)①共价化合物的电子式由对应原子的电子式组成,并要表示出两原子之间的共用电子对情况;
②反应A中,4mol HCl被氧化,放出115.6kJ的热量,依据热化学方程式书写方法,标注物质聚集状态和对应焓变写出;
③反应热△H=反应物总键能-生成物的总键能,据此计算H-O键与H-Cl键的键能差,进而计算断开1mol H-O键与断开1mol H-Cl键所需能量差.
解答 解:(1)5.8g丁烷的物质的量为$\frac{5.8g}{58g/mol}$=0.1mol,则2mol丁烷燃烧放热288kJ×20=5760kJ,丁烷燃烧的热化学方程式为2C4H10(g)+13O2(g)=8CO2(g)+10H2O(l)△H=-5760kJ/mol,
故答案为:2C4H10(g)+13O2(g)=8CO2(g)+10H2O(l)△H=-5760kJ/mol;
(2)已知 ①2CH4(g)+3O2(g)═2CO(g)+4H2O(l)△H1=-1214.6KJ/mol,
②2CO(g)+O2(g)═2CO2(g)△H2=-566kJ/mol,
由盖斯定律可知$\frac{1}{2}$(①+②)得CH4(g)+2O2(g)=CO2(g)+2H2O (l)△H=$\frac{1}{2}×$(-1214.6KJ/mol-566kJ/mol)=-890.3kJ/mol,
故答案为:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3kJ/mol;
(3)①H2O是共价化合物,是由原子和氢原子形成共价键,电子式为 ,
,
故答案为: ;
;
②依据反应A中,4mol HCl被氧化,放出115.6kJ的热量,反应的热化学方程式为:4HCl(g)+O2(g)?2Cl2(g)+2H2O(g)△H=-115.6 KJ/mol,
故答案为:4HCl(g)+O2(g)?2Cl2(g)+2H2O(g)△H=-115.6 KJ/mol;
③E(H-O)、E(HCl)分别表示H-O键能、H-Cl键能,反应A中,4mol HCl被氧化,放出115.6kJ的热量,反应热△H=反应物总键能-生成物的总键能,故:4×E(H-Cl)+498kJ/mol-[2×243kJ/mol+4×E(H-O)]=-115.6kJ/mol,整理得,4E(H-Cl)-4E(H-O)=-127.6kJ/mol,即E(H-O)-E(HCl)=31.9kJ/mol,
故断开1mol H-O键与断开1mol H-Cl键所需能量相差约为31.9kJ/mol×1mol=31.9kJ,所以H2O中H-O 键比HCl中H-Cl键强;
故答案为:31.9;强.
点评 本题考查了焓变等于反应物的键能和减去生成物的键能和、热化学方程式的书写,题目难度中等,掌握盖斯定律及反应热的计算方法是关键.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液态植物油通过催化加氢可制得人造奶油 | |
| B. | 饱和(NH4)2SO4溶液可使蛋白质变性 | |
| C. | 淀粉和蛋白质的组成元素相同 | |
| D. | 石蜡油经分馏可以获得乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg(OH)2[Al(OH)3] | B. | MgCl2(AlCl3) | C. | Mg(Al) | D. | MgO(Al2O3) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、Fe2+、MnO4-、SO42- | B. | Ca2+、H+、SO42-、HCO3- | ||
| C. | Na+、Cu2+、Cl-、S2- | D. | Fe3+、K+、SCN-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
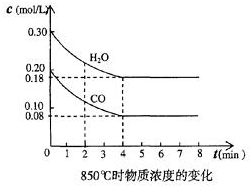 (1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示正反应程度越大反应进行越完全,反应的转化率越大,K值大小与温度的关系是:温度升高,K值可能增大也可能减小(填一定增大、一定减小、或可能增大也可能减小).
(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示正反应程度越大反应进行越完全,反应的转化率越大,K值大小与温度的关系是:温度升高,K值可能增大也可能减小(填一定增大、一定减小、或可能增大也可能减小).| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.38 | 0.238 | 0.062 | 0.062 |
| 3 | c | c2 | c3 | c3 |
| 4 | c | c2 | c3 | c3 |
| 5 | 0.6 | 0.26 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在标准状况下,NA 个水分子所占的体积约为 22.4L | |
| B. | 20℃、1.01×105Pa 时,0.5mol O2的质量是 16 g | |
| C. | 同温同压下,1mol He 与 6.02×1023个 N2 所占体积相等 | |
| D. | 1mol CH4的质量与NA个CH4分子的质量相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯酚钠溶液中通入少量CO2:2C6H5O-+CO2+H2O→2C6H5OH+CO32- | |
| B. | 甲醛溶液中加入足量的银氨溶液并加热:HCHO+2[Ag(NH3)2]++2OH-$\stackrel{△}{→}$HCOO-+NH4++2Ag↓+3NH3+H2O | |
| C. | 向小苏打溶液中加入醋酸:HCO3-+H+═CO2↑+H2O | |
| D. | 乙醛与碱性氢氧化铜悬浊液混合后加热至沸腾:CH3CHO+2Cu(OH)2+OH-$\stackrel{△}{→}$Cu2O↓+CH3COO-+3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中C(OH-)=0.1mol•L-1 | B. | 溶液中C(OH-)>C(H+) | ||
| C. | 该氨水的浓度为0.1mol•L-1 | D. | 溶液中水的离子积为1×10-14 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com