
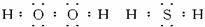
(1)乙元素在元素周期表中的位置_________,H的电子式_________。
(2)写出反应①的离子方程式:__________________。
(3)将甲元素单质和石墨用导线相连,放在E溶液中,构成了原电池,写出该原电池的负极电极反应式:____________________________________。
(4)反应②中
(1)第3周期ⅥA ![]()
(2)Al(OH)3+3H+![]() Al3++3H2O
Al3++3H2O
(3)Al-3e-+4OH-![]()
![]() +2H2O
+2H2O
(4)CH4(g)+2O2(g)![]() CO2(g)+2H2O(l);ΔH=-889.6 kJ·mol-1
CO2(g)+2H2O(l);ΔH=-889.6 kJ·mol-1
解析:本题综合考查了元素化合物的推断,原电池原理和热化学方程式的书写。根据已知条件可推出:甲是Al,乙是S,B是过氧化钠,C是甲烷,X是水,D是氢氧化铝,H是二氧化碳。书写原电池半极反应式注意:负极发生氧化反应,正极发生还原反应。根据物质或离子的氧化性或还原性判断发生的半反应。Al和石墨组成原电池,Al一定作负极。ΔH=-55.6 kJ·g-1×


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:





| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:013
下列事实能判断甲金属元素的金属性一定比乙强的有( )
①甲单质能与乙盐的溶液反应;
②甲、乙两元素原子的最外层电子数相同,且甲的原子半径小于乙;
③甲、乙是短周期元素原子且电子层数相同,甲的原子序数小于乙;
④两单质分别与氯气反应时生成阳离子,甲失去的电子数比乙多.
A.全部可以
B.仅②不可以
C.仅②④不可以
D.仅③可以
查看答案和解析>>
科目:高中化学 来源:物理教研室 题型:013
①甲单质能与乙盐的溶液反应;
②甲、乙两元素原子的最外层电子数相同,且甲的原子半径小于乙;
③甲、乙是短周期元素原子且电子层数相同,甲的原子序数小于乙;
④两单质分别与氯气反应时生成阳离子,甲失去的电子数比乙多.
A.全部可以
B.仅②不可以
C.仅②④不可以
D.仅③可以
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com