
【题目】下列说法不正确的是
A.可溶性铜盐有毒,生命体中不含铜元素
B.金属材料分为黑色金属材料和有色金属材料
C.光线通过胶体时,看到的光柱是被胶体粒子散射的现象
D.稀土金属用途广泛被誉为 新材料的宝库,可单独使用,亦可用于生成合金
 互动英语系列答案
互动英语系列答案科目:高中化学 来源: 题型:
【题目】利用下图所示实验装置能验证热稳定性Na2CO3强于NaHCO3。请回答:
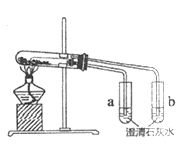
(1) NaHCO3受热分解的化学方程式是_________。
(2)证明热稳定性Na2CO3强于NaHCO3的实验现象是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是重要的无机化工产品之一,在国民经济中占有重要地位。我国采用铁触媒(以铁为主的混合物)做催化剂合成氨。回答下列问题:
(1)Fe基态原子核外电子排布式为____。氮化铁是一种重要的无机化合物,不溶于水,暴露在潮湿环境中可释放出氨气,元素Fe和N中,第一电离能较大的是_____,基态原子核外未成对电子数较多的是_______。
(2)N的氧化物有N2O等,N2O与CO2互为等电子体,N2O的空间构型为__________。
(3)N有多种氢化物,其中肼(N2H4)常用作火箭推进剂的燃料,N2H4中N原子的杂化形式为____。
(4)N、P、As为同族元素,NH3、PH3、AsH3三种物质的沸点由高到低的顺序为_____。原因是____。
(5)K3[Fe(CN)6]常用于检验Fe2+,K3[Fe(CN)6]中存在的化学键类型有_______。
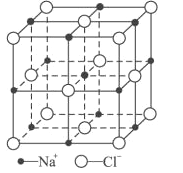
(6)FeO晶体的晶胞与NaCl的相似,NaCl的晶胞如图所示。由于晶体缺陷,某氧化亚铁晶体的实际组成为Fe0.9O,其中包含有Fe2+和Fe3+,晶胞边长为428pm,则该晶体的密度为____g/cm3(列出计算式即可,用NA表示阿伏加德罗常数的值)。
 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列各题:
(1)相同质量的O2和O3所含氧原子的个数比为______,标准状况下气体的体积之比为_______;
某19g二价金属氯化物(ACl2)中含有0.4mol Cl-,则ACl2的摩尔质量是_______。
(2)某反应中反应物与生成物有:NH3、H2SO4、KClO3、K2SO4、HNO3、H2O和一种未知物质X。
①已知 KClO3在反应中得到电子,则该反应的还原剂是____。
②已知 0.2mol KClO3在反应中得到1mol电子生成X,则X的化学式为____。
③根据上述反应可推知还原性: NH3____X (填>、<符号)。
(3)已知反应:
①SO3+H2O=H2SO4 ②Cl2+H2O=HCl+HClO ③2F2+H2O=4HF+O2
④2Na+2H2O=2NaOH+H2↑ ⑤Na2O+H2O=2NaOH ⑥Fe2O3+3H2![]() 2Fe+3H2O
2Fe+3H2O
上述反应中,不属于氧化还原反应的有_________(填序号,下同);H2O只做氧化剂的是_____;属于氧化还原反应,但反应物中的H2O既不被氧化也不被还原的是________。
(4)反应2KMnO4+16HCl(浓)=2MnCl2+2KCl+5Cl2↑+8H2O能制备氯气,该反应中,氧化剂是______________。反应中被氧化的HCl和未被氧化HCl的物质的量之比为________。
(5)铜与稀硫酸、双氧水混合能制备硫酸铜,写出反应的离子方程式:_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电化学装置的说法正确的是
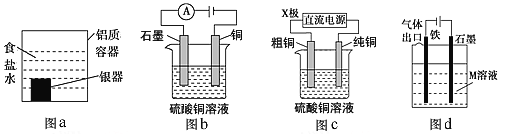
A. 利用图a装置处理银器表面的黑斑Ag2S,银器表面的反应为Ag2S+2e-=2Ag+S2-
B. 图b电解一段时间,铜电极溶解,石墨电极上有亮红色物质析出
C. 图c中的X极若为负极,则该装置可实现粗铜的精炼
D. 图d中若M是海水,该装置是通过“牺牲阳极的阴极保护法”使铁不被腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 烷烃的通式为 CnH2n+2,随 n 值增大,碳元素的质量百分含量逐渐减小
B. 乙炔与苯的实验式为 CH,是含碳量最高的物质
C. 1 摩尔苯恰好与 3 摩尔氢气完全加成,说明一个苯分子中有三个碳碳双键
D. n=7,主链上有 5 个碳原子的烷烃共有五种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据2Fe2++Cl2=2Fe3++Cl-;2Fe3++Cu=2Fe2++Cu2+;Fe+Cu2+=Fe2++Cu上述反应判断氧化剂的氧化性强弱顺序正确的是
A.Cl2>Fe3+>Cu2+B.Fe3+>Cl2>Cu2+
C.Cu2+>Fe3+>Cl2D.Cl2>Cu2+>Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知 A、B、C、D是原子序数依次增大的四种短周期主族元素,A的周期数等于其主族序数, A的原子半径小于B,B原子的价电子排布为nsnnpn,D是地壳中含量最多的元素。E是第四周期的p区元素且最外层只有2对成对电子,F元素的基态原子第四能层只有一个电子,其它能层均已充满电子。
(1)基态E原子的价电子排布图_______________。
(2)B、C、D三元素第一电离能由大到小的顺序为(用元素符号表示)______________。
(3)BD![]() 中心原子杂化轨道的类型为______杂化;CA
中心原子杂化轨道的类型为______杂化;CA![]() 的空间构型为_______(用文字描述)。
的空间构型为_______(用文字描述)。
(4)1 mol BC-中含有π键的数目为______。
(5)比较D、E元素最简单氢化物的稳定性_______(填化学式,用“>”连接),理由是_______________。
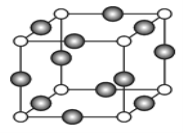
(6)C、F两元素形成的某化合物的晶胞结构如图所示,则该化合物的化学式是____,C原子的配位数是_____。若相邻C原子和F原子间的距离为anm,阿伏伽德罗常数为NA,则该晶体的密度为______g/cm3(用含a、NA的符号表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把一块镁铝合金投入到1mol/L盐酸中,待合金完全溶解后(盐酸有剩余),再往溶液里加入1mol/LNaOH溶液,生成沉淀的物质的量随加入NaOH溶液体积的变化如图所示。下列说法中错误的是( )
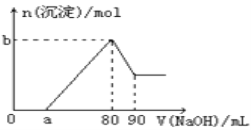
A. 盐酸的体积为80mL
B. a的取值范围为0<a<50
C. 当a值为30时,b值为0.01
D. n(Mg2+)<0.025mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com