
| A. | SO2通入到BaCl2溶液中:Ba2++SO2+H2O=BaSO3↓+2H+ | |
| B. | 浓H2SO4与硫化亚铁制取H2S气体:H2SO4+FeS=Fe2++SO42-+H2S↑ | |
| C. | SO2使溴水褪色:SO2+2H2O+Br2=4H++SO42-+2Br- | |
| D. | 氯化铵固体与熟石灰共热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O |
分析 A.亚硫酸钡溶于盐酸,该反应不会发生;
B.硫酸为强酸,离子方程式中硫酸应该拆开;
C.二氧化硫具有还原性,能够被溴水氧化生成硫酸;
D.固体之间的反应,不是发生在溶液中,不能书写离子方程式.
解答 解:A.BaSO3溶液盐酸,则氯化钡与二氧化硫不发生反应,故A错误;
B.浓H2SO4与硫化亚铁制取H2S气体,硫酸不能保留分子式,正确的离子方程式为:2H++FeS=Fe2++H2S↑,故B错误;
C.SO2使溴水褪色,反应的离子方程式为:SO2+2H2O+Br2=4H++SO42-+2Br-,故C正确;
D.氯化铵固体与熟石灰共热,该反应不是在溶液中进行的,无法书写离子方程式,故D错误;
故选C.
点评 本题考查了离子方程式的书写判断,为高考的高频题,题目难度中等,注意掌握离子方程式正误判断常用方法,如:检查反应能否发生,检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.


 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:解答题
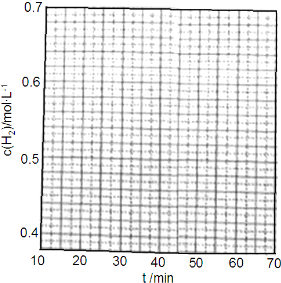
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D是中学化学常见的四种物质,它们之间的相互转化关系如下(部分反应条件及产物略去).
A、B、C、D是中学化学常见的四种物质,它们之间的相互转化关系如下(部分反应条件及产物略去).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丁烷的球棍模型 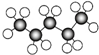 | B. | 乙烯的比例模型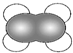 | ||
| C. | 乙醛的结构简式CH3COH | D. | 键线式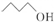 表示的有机物名称为1-戊醇 表示的有机物名称为1-戊醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCHO和CH3COOH | B. | HCOOCH3和CH3COOH | ||
| C. | HCOOH和CH3COOH | D. | CH3CH2OH和CH3OCH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
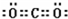 ;E的单质在空气中燃烧所生成物质的化学式SO2.
;E的单质在空气中燃烧所生成物质的化学式SO2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠和镁分别与冷水反应,判断钠和镁金属性强弱 | |
| B. | 在MgCl2与AlCl3溶液中分别加入过量的NaOH溶液,判断镁与铝的金属性强弱 | |
| C. | 往硅酸钠溶液中通入CO2产生白色沉淀,判断碳酸与硅酸的酸性强弱 | |
| D. | 根据HF和HCl的水溶液的酸性强弱判断氟与氯的非金属性的强弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若2H2(g)+O2(g)=2H2O(g)△H=-483.6 kJ/mol,则H2燃烧热为241.8 kJ/mol | |
| B. | 若P4(白磷,s)=4P(红磷,s)△H=-29.2kJ/mol,则红磷比白磷稳定 | |
| C. | 已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=-57.4 kJ/mol,则20.0g NaOH固体与稀盐酸完全中和,放出28.7 kJ的热量 | |
| D. | 已知2C(s)+2O2(g)=2CO2(g)△H1;2C(s)+O2(g)=2CO(g)△H2,则△H1>△H2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com