
 ���µ�������ʾ���������������л�����β��ռ22.2%��ȼúռ16.7%���ﳾռ16.3%����ҵռ15.7%���ݷ���������Ҫ��������Դ��ͼ��ʾ�����д�ʩ�����ܸ��ƿ����������ǣ�������
���µ�������ʾ���������������л�����β��ռ22.2%��ȼúռ16.7%���ﳾռ16.3%����ҵռ15.7%���ݷ���������Ҫ��������Դ��ͼ��ʾ�����д�ʩ�����ܸ��ƿ����������ǣ�������| A�� | Ӧ�ø�Ч�ྻ����Դת���������ڴ���ȼú��¯�ϰ�װ�͵�ȼ���������������������� | |
| B�� | �����̻���𣬼�ǿ��·�ﳾ��Ⱦ���ƣ�ǿ��·�汣�࣬��ˮ���� | |
| C�� | �����ͳ��������������糧�ȣ��ƹ��ʹ������������������������ŷ� | |
| D�� | �о���ú�������¼������������ͣ����͵���Դ�Ĺ�Ӧ�����ᳫ�������������ִ��������������� |
���� A��ú�к���NԪ��ȼ�պ����������������Ⱦ�������ƹ�ʹ�������������������ε�����������Ⱦ��
B�������̻���𣬵�·����ˮ���Է�����
C��ú�к�����Ԫ��ȼ�պ��������������Ⱦ�������ƹ�ʹ��ȼú������������SO2��Ⱦ��
D�������˻�ʯȼ�ϵ��������������ܸ��ƿ���������
��� �⣺A��ú�к���NԪ��ȼ�պ����������������Ⱦ�������ƹ�ʹ�������������������ε�����������Ⱦ�����Ը��ƿ�����������A��ѡ��
B�������̻���𣬼�ǿ��·�ﳾ����ǿ��·�汣����ˮ�������ɽ��Ϳ����й���Ư����ĺ��������Ը��ƿ�����������B��ѡ��
C�������ͳ��������������糧�ȣ��ƹ��ʹ������������������������ŷţ����Ը��ƿ�����������C��ѡ��
D��Ӧ�����µ�������Դ������ú��ʯ�͵�ʹ�ã����������������ִ��������������������˻�ʯȼ�ϵ��������������ܸ��ƿ�����������Dѡ��
��ѡ��D��
���� ���⿼������Դ����������֪ʶ����ȷ������ȾԴ�����������ǽ���ؼ���ע������֪ʶ�Ļ��ۣ��������ܼ��ŵ����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ڽ���Ԫ����ǽ���Ԫ�صķֽ��߸�������Ѱ���Ʊ��뵼����ϵ�Ԫ�� | |
| B�� | ����Ԫ���п�Ѱ���Ʊ����������¡���ʴ���ϵ�Ԫ�� | |
| C�� | �ڷǽ���Ԫ���������Ѱ���Ʊ�����ũҩ���ϵ�Ԫ�� | |
| D�� | ���ڱ��еڢ���Ԫ��������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | SiO2+4HF=SiF4��+2H2O���������ʴ�̲��� | |
| B�� | 4Na+TiCl4 $\frac{\underline{\;����\;}}{\;}$4NaCl+Ti���ý�����������TiCl4��Ӧ��ȡ����Ti | |
| C�� | CO32-+H2O?H2CO3+OH-�����ȵĴ�����Һ��ϴ�;����� | |
| D�� | MgCl2$\frac{\underline{\;���\;}}{\;}$Mg+Cl2������ҵ���õ�������Ȼ�þ��ȡ����þ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | A-x+n+48 | B�� | A-x-n-24 | C�� | A-x+n+24 | D�� | A+x-n-24 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ʢŨ������Լ�ƿ�ɿ�����ɫ����������˵��HCl���ȶ� | |
| B�� | �����е���Ũ���ᣬ���DZ�ڣ���˵��Ũ�������������� | |
| C�� | ����Һ�еμ��ữ��Ba��NO3��2��Һ���ְ�ɫ������˵������Һ��һ����SO42- | |
| D�� | ̼�ᡢ������ʹ����ᶼ�Dz��ȶ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
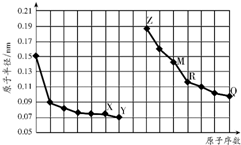
| A�� | R�����ڱ��ĵ�14�� | |
| B�� | Y��Q����Ԫ�ص���̬�⻯�P������������ˮ�����Ϊǿ�� | |
| C�� | �����ӵİ뾶��X��Z��M | |
| D�� | Z�ĵ����ܴ�M��QԪ�ع��ɵ�����Һ���û�������M |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 84 g NaHCO3�������NA��CO32- | |
| B�� | �����£�14.0 g��ϩ�Ͷ�ϩ�Ļ�������к���C-H����ĿΪ2.0NA | |
| C�� | ��⾫��ͭʱ����������������6.4 g�����·��ת�Ƶ�����Ϊ0.2NA | |
| D�� | 78 g Na2O2��������CO2��Ӧ������ת�Ƹ���Ϊ2NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ��ѧʽ | ���볣�� |
| CH3COOH | K=1.7��10-5 |
| HCN | K=4.9��10-10 |
| H2CO3 | K1=4.3��10-7��K2=5.6��10-11 |
| A�� | H2CO3��HCO3-��CH3COO-��CN- | B�� | HCO3-��CH3COOH��CN-��CO32- | ||
| C�� | HCN��HCO3-��CN-��CO32- | D�� | HCN��HCO3-��CH3COO-��CN- |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com