
【题目】下列各分子中所有原子都满足最外层为8电子结构的是( )
A. BeCl2B. PCl3C. PCl5D. BF3
 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:
【题目】A~H8种物质存在如下转化关系(反应条件,部分产物未标出)。已知:A是酸式盐,B是能使品红溶液褪色的气体,G是红棕色气体。按要求回答问题:
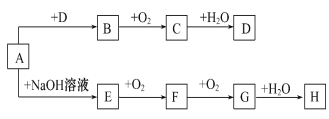
(1)写出下列物质的化学式:A___________。
(2)写出下列反应的化学方程式:
B与E按1:2通入水中_________;
G→H_______
D的浓溶液与红热的木炭反应的方程式:______
(3)检验某溶液中是否含D中阴离子的方法:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种熔融碳酸盐燃料电池原理示意如图。下列有关该电池的说法正确的是( )
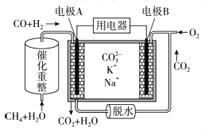
A. 反应CH4+H2O==3H2+CO,每消耗11.2L CH4转移3mol电子
B. 电极B上发生的电极反应为O2+2CO2+4e-==2CO32-
C. 电池工作时,电子通过熔融盐由电极B向电极A移动
D. 电极A上CO参与的电极反应为CO+4OH- —2e- == CO32-+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】传统硅酸盐材料因其耐高温、抗腐蚀、强度高等优异性能,被广泛应用于各种工业、科学研究及日常生活中。某硅酸盐材料的主要成分为氧化钙、二氧化硅,并含有一定量铁、铝及镁的氧化物,某研究小组设计以下流程测定该硅酸盐材料中钙的含量(如下图所示)。

部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度以0.1mol·L-1计)
沉淀物 | Fe(OH)3 | Fe(OH)2 | Ca(OH)2 | Al(OH)3 | Mg(OH)2 |
开始沉淀pH | 2.7 | 7.6 | 12.3 | 4.0 | 8.0 |
完全沉淀pH | 3.7 | 9.6 | 14.3 | 5.2 | 12.4 |
回答下列问题:
(1)酸浸后,加入双氧水所发生反应的离子方程式为_________________。为提高钙的浸出率,可以采取的措施是________________________。(任写一种)
(2)沉淀B的成份为_____________。调节滤液Ⅰ的pH为4~5,加入的物质可以是_________。
A. CaCO3 B. Ca(OH)2 C. 氨水 D. MgO
(3)向滤液Ⅱ中加足量草酸铵溶液,在水浴上保温陈化2小时,冷却到室温,过滤、洗涤沉淀。将得到的CaC2O4沉淀溶解在硫酸中,并稀释配成250mL溶液。用移液管量取25.00 mL溶液于锥形瓶中,用KMnO4标准溶液滴定。滴定时发生反应的离子方程式为___________________________。若实验中所取样品质量为4.00 g ,KMnO4标准溶液浓度为0.0500 mol/L,平行滴定3次用去KMnO4标准溶液体积平均值为36.00 mL,则该硅酸盐样品中钙的质量分数为_________。
(4)在保温沉钙环节,若样品中镁的含量过高,会导致最终测定结果产生较大误差。试从理论上计算,加草酸铵溶液沉钙时,溶液中镁离子的浓度最高不能超过____mol/L。(已知:Ksp(CaC2O4) = 4.00×10-9,Ksp(MgC2O4) = 4.83×10-6)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种天然气臭味添加剂的绿色合成方法为:CH3CH2CH=CH2+H2S ![]() CH3CH2CH2CH2SH。下列反应的原子利用率与上述反应相近的是
CH3CH2CH2CH2SH。下列反应的原子利用率与上述反应相近的是
A. 乙烯与水反应制备乙醇
B. 苯和硝酸反应制备硝基苯
C. 乙酸与乙醇反应制备乙酸乙酯
D. 甲烷与Cl2反应制备一氯甲烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应为放热反应的( )
①CaCO3分解 ②钠与水反应 ③硫在O2中燃烧 ④8个结晶水的氢氧化钡与氯化铵的反应 ⑤CaO+H2O=Ca(OH)2 ⑥N2与H2合成NH3 ⑦NaOH和CH3COOH的反应
A. ①②③B. ④⑤⑦C. ④⑦⑧D. ②③⑤⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温常压下为无色液体,而且密度大于水的是
①苯 ②硝基苯 ③溴苯 ④四氯化碳 ⑤溴乙烷 ⑥乙酸乙酯
A. ②③④⑤B. ③④⑤⑥C. ①⑥D. ②③④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气中的主要污染物是 NO、NO2 和 CO。处理汽车尾气,可实现绿色环保、节能减排。
(1)用 NaOH 溶液吸收 NO、NO2,当 n(NO)∶n(NO2)=1 时只生成一种盐,该盐的化学式为 _________ 。
(2)已知:①CO 的燃烧热△H1=-282 kJ·mol-1;
②N2(g)+O2(g)=2NO(g)△H2=+183 kJ·mol1。
写出 NO 和 CO 反应生成无污染性气体的热化学反应方程式______________________。
(3)在密闭容器中充入 10molCO 和 8molNO,发生反应,如图为平衡时 NO 的体积分数与温度,压强的关系。
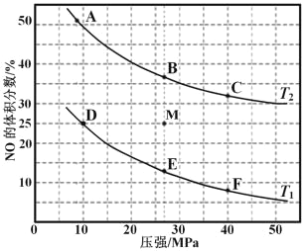
①若反应在恒容密闭容器中进行,下列图像正确且能说明反应达到平衡状态的是_____。
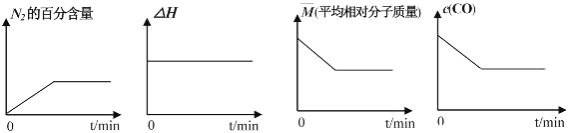
A B C D
②该反应达到平衡后,为在提高反应速率的同时提高 NO 的转化率,可采取的措施有_____(填字母)。
A.升高温度 B.缩小容器的体积
C.增加 CO 的浓度 D.改用高效催化剂
③在压强为 10MPa、温度为 T1 条件下,若反应进行到 20 min 达到平衡状态,容器的体积为 4 L,则此时 NO 的转化率=________________ ,用 N2 的浓度变化表示的平均反应速率 v(N2)= _______________,该温度下平衡常数 Kp=___________________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数;保留两位有效数字)。
④若在 M 点对反应容器降温,同时缩小体积至体系压强增大,重新达到的化学平衡状态可能是图中 A~F 点中的_____点。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在空气中,钢铁与食盐水接触,发生吸氧腐蚀,在负极上发生的电极反应是( )
A. Fe-2e-=Fe2+B. 2H++2e-=H2↑
C. Na++e-=NaD. 2H2O+O2+4e-=4OH-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com