
| A. | 44gC3H8中含有的非极性键数为2NA | |
| B. | 在常温常压下,0.1mol铁与0.1mol Cl2充分反应,转移的电子数为0.3NA | |
| C. | 200 mL 1 mol/L Al2(SO4)3溶液中,Al3+和SO42-离子数的总和小于NA | |
| D. | O2和O3的混合物共6.4g,其中所含氧原子数一定为0.4 NA |
分析 A.44gC3H8的物质的量为$\frac{44g}{44g/mol}=1mol$,其中非极性键为C与C之间形成的,因此1mol44gC3H8中含有非极性键数目为2mol;
B.常温常压下,Fe与氯气反应生成FeCl3,反应转移的电子数按完全反应的物质来算;
C.200 mL 1 mol/L Al2(SO4)3溶液中,含有0.4molAl3+和0.6molSO42-,但Al3+会发生水解,溶液中Al3+物质的量<0.4mol;
D.O2和O3的混合物可视为仅含有O,6.4g混合物中,含有O的物质的量为$\frac{6.4g}{16g/mol}=0.4mol$.
解答 解:A.44gC3H8的物质的量为$\frac{44g}{44g/mol}=1mol$,1mol44gC3H8中含有非极性键数目为2mol,即2NA,故A正确;
B.常温常压下,Fe与氯气反应生成FeCl3,反应方程式为:2Fe+3Cl2═2FeCl3,0.1mol铁与0.1mol Cl2充分反应,因此Fe是过量的,0.1molCl2完全反应,Cl由0价降低为-1价,0.1molCl2转移电子数为0.1mol×2=0.2mol,即0.2NA,故B错误;
C.200 mL 1 mol/L Al2(SO4)3溶液中,含有0.4molAl3+和0.6molSO42-,但Al3+会发生水解,溶液中Al3+物质的量<0.4mol,则溶液中Al3+和SO42-离子数的总和小于1mol,即NA,故C正确;
D.O2和O3的混合物可视为仅含有O,6.4g混合物中,含有O的物质的量为$\frac{6.4g}{16g/mol}=0.4mol$,所以其中所含氧原子数一定为0.4mol,即0.4NA,故D正确.
故选B.
点评 本题考查阿伏伽德罗常数的知识,注意常温常压和标准状况第气体摩尔体积的影响.题目难度不大,是基础题.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 编号溶液 | 1 | 2 | 3 | 4 |
| KMnO4(mL) | 20.01 | 19.00 | 19.99 | 20.00 |
| Na2SO3(mL) | 25.00 | 25.00 | 25.00 | 25.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
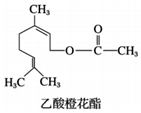 乙酸橙花酯是一种食用香料,其结构简式如图,关于该有机物的叙述中正确的是( )
乙酸橙花酯是一种食用香料,其结构简式如图,关于该有机物的叙述中正确的是( )| A. | ②④⑤ | B. | ①④⑤ | C. | ②③⑥ | D. | ②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向溶液中加入5 mL 0.01mol/L NaOH,所得溶液中离子的浓度一定符合:c(Na+)+c(H+)═c(OH-)+c(ClO-) | |
| B. | 25℃时,若溶液的pH=5,则Ka(HClO)=l×10-7 | |
| C. | 向溶液中加入少量NH4Cl固体,溶液中$\frac{c(HClO)}{c(Cl{O}^{-})}$的值变小 | |
| D. | 向溶液中加入10 mL O.01mol/L NaOH,所得溶液中离子浓度的大小顺序为:c(Na+)>c(ClO-)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
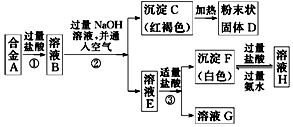 铁和铝是日常生活中用途广泛的金属.
铁和铝是日常生活中用途广泛的金属.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稳定性:NH3>PH3>AsH3 | B. | 离子半径:Li+>O2->F- | ||
| C. | 酸性:H3PO4<H2SO4<HClO4 | D. | 碱性:LiOH<NaOH<KOH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com