
【题目】化学反应伴随能量变化,其中能量的主要形式是热能。
I:如图所示,把试管放入盛有25℃饱和澄清石灰水的烧杯中,往试管中放入几小块镁片,再用滴管滴入5mL盐酸于试管中,试回答下列问题:
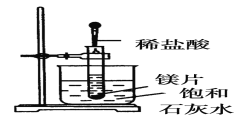
(1)实验中观察到的现象是________________________。
(2)产生上述现象的原因是________________________。
(3)写出有关反应的离子方程式__________________________。
(4)由实验推知,MgCl2和H2的总能量________(填“大于”“小于”或“等于”)镁片和HCl的总能量。
II:从能量变化的角度研究反应:2H2+O2=2H2O。
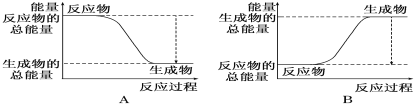
(1)如图能正确表示该反应中能量变化的是_________。
(2)已知断开或形成1 mol化学键吸收或放出的能量,叫做该化学键的键能,单位为kJ·mol-1。一些键能数据如下表:
化学键 | H—H | O=O | H—O |
键能(kJ·mol-1) | 436 | 496 | 463 |
请回答:
断裂反应物2 mol H2和1 mol O2的化学键,需要_______的总能量为______kJ;形成生成物2 mol H2 O的化学键,需要______的总能量为______kJ。所以该反应能量变化值的大小 ____________ kJ(填数值)。
【答案】镁片逐渐溶解,有大量气泡产生,烧杯中溶液变浑浊 镁与盐酸反应产生氢气,该反应为放热反应,Ca(OH)2在水中的溶解度随温度升高而减小,故析出Ca(OH)2晶体 Mg+2H+=Mg2++H2↑ 小于 A 吸收 1368 放出 1852 484
【解析】
Ⅰ.试管放入盛有25℃饱和澄清石灰水的烧杯中,往试管中放入几小块镁片,再用滴管滴入5mL盐酸于试管中,镁是活泼金属,可与酸发生反应,反应放热,由于Ca(OH)2的溶解度随温度的升高而降低,因此随着反应的进行会有Ca(OH)2析出,从而饱和石灰水变浑浊,据此分析解答;
Ⅱ.(1)反应物的总能量大于生成物的总能量时,反应为放热反应,反应物的总能量小于生成物的总能量时,反应为吸热反应,氢气与氧气反应生成水为放热反应,据此分析解答;
(2)1molH2中含有1molH—H键,1molO2中含有1molO—O键,1molH2O含有2molH—O键,结合键能数据进行计算。
Ⅰ.(1)镁与稀盐酸会发生反应:Mg+2HCl=MgCl2+H2↑,该反应为放热反应,因Ca(OH)2溶解度随温度升高而降低,故实验现象为:镁片上有大量气泡产生,镁片逐渐溶解,烧杯中溶液变浑浊,故答案为:镁片上有大量气泡产生,镁片逐渐溶解,烧杯中溶液变浑浊;
(2)由(1)分析可知,产生上述现象的原因是:镁与盐酸反应生成氢气,且该反应放热,Ca(OH)2的溶解度随温度升高而减小,故有固体析出,故答案为:镁与盐酸反应生成氢气,且该反应放热,Ca(OH)2的溶解度随温度升高而减小,故有固体析出;
(3)镁与盐酸反应的离子方程式为:Mg+2H+=Mg2++H2↑,故答案为:Mg+2H+=Mg2++H2↑;
(4)该反应为放热反应,即反应物总能量高于生成物总能量,故MgCl2溶液和H2的总能量小于镁片和盐酸的总能量,故答案为:小于;
Ⅱ.(1)氢气燃烧是放热反应,这说明反应物的总能量高于生成物的总能量,因此能正确表示该反应中能量变化的是A,故答案为:A;
(2)由于断键吸收能量,则拆开2molH2化学键需要吸收2mol×436kJ/mol=872kJ,拆开1molO2化学键需要吸收能量是1mol×496kJ/mol=496kJ,则断键共需要吸收的能量是872kJ+496kJ=1368kJ;形成4molH-O键放出的能量是4mol×463kJ/mol=1852kJ,所以2mol氢气反应最终放出的能量是1852kJ-1368kJ=484kJ,故答案为:吸收;1368;放出;1852;484。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】途经张家界的黔张常铁路是我国“八纵八横”高速铁路网之一,于2019年12月26日开通,高铁的铝合金车体的优势是:制造工艺简单,节省加工费用;减重效果好;有良好的运行品质;耐腐蚀,可降低维修费。工业上制备铝一般是从铝土矿(主要成分是Al2O3,含有Fe2O3杂质)中得到纯净的Al2O3,然后电解Al2O3得到铝。下图是从铝土矿中提纯Al2O3的简单示意图。其中涉及到的一个反应是:2NaAlO2+CO2+3H2O=Na2CO3+2Al(OH)3↓。
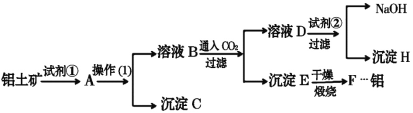
(1)图示中实验操作(1)是________;加入的试剂②是__________(填化学式)。
(2)试写出下列物质(或溶液中的溶质)的化学式:B__________________;D__________________;H________________。
(3)写出化学方程式:
①铝土矿→A:_____________________________________。
②E→F:_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨法溶浸氧化锌烟灰制取高纯锌的工艺流程如下图所示。溶浸后氧化锌烟灰中锌、铜、镉、砷元素分别以Zn(NH3)42+、Cu(NH3) 42+、Cd(NH3)42+、AsCl52-的形式存在。
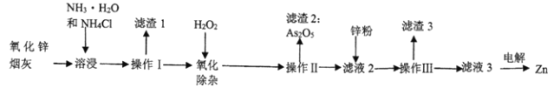
请回答下列问题:
(1)当NH4Cl、NH3·.H2O的混合溶液中存在c(NH4+)=c(Cl-)时,溶液呈___(填“酸”、“碱”或“中”)性。
(2)Zn(NH3)42+中Zn的化合价为____,“溶浸”中ZnO发生反应的离子方程式为____。
(3)一定时间内,锌浸出率与温度的关系如图所示,分析30℃时锌浸出率最高的原因为_____。
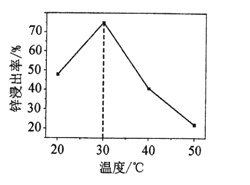
(4)实验室实现操作II”所用的玻璃仪器有___,玻璃棒和烧杯等 “滤渣3”的主要成分为__。
(5)“电解”时Zn(NH3)42+在阴极放电的电极反应式为_____。电解后的电解液经补充__(写一种物质的化学式)后可返回“溶浸”工序继续使用。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生利用下面实验装置探究盐桥式原电池的工作原理(Cu:相对原子质量为64)。
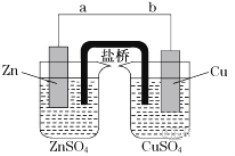
按照实验步骤依次回答下列问题:
(1)导线中电子移动方向为___(用a、b表示)。
(2)原电池的正极为__。
(3)写出装置中铜电极上的电极反应式:___。
(4)若装置中铜电极的质量增加32g,则导线中转移的电子数目为__。
(5)装置的盐桥中除添加琼脂外,还要添加KCl的饱和溶液,电池工作时,盐桥中的K+向__(填“左侧”或“右侧”)烧杯移动。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,用pH试纸测得0.1 mol·L-1 NaNO2溶液的pH>7.
(1)NaNO2溶液pH>7的原因是(用离子方程式表示) ________,NaNO2溶液中c(HNO2)=________ (用溶液中其他离子的浓度关系式表示).
(2)常温下,将0.2 mol·L-1的HNO2和0.1 mol·L-1的NaOH溶液等体积混合,所得溶液的pH<7,说明HNO2的电离程度_______ (填“大于”或“小于”)NaNO2的水解程度.该混合溶液中离子浓度由大到小的顺序是______________.
(3)常温下,pH=3的HNO2溶液和pH=11的NaOH溶液等体积混合后溶液pH_________7,c(Na+) __________c(NO2-)(填“大于”或“小于”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环之间公用一个碳原子的化合物称为螺环化合物,螺[2,2]戊烷(![]() )是最简单的一种。下列关于该化合物的说法错误的是( )
)是最简单的一种。下列关于该化合物的说法错误的是( )
A. 与环戊烯互为同分异构体B. 二氯代物超过两种
C. 生成C5H12时至少需要2molH2D. 所有碳原子均处于同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1869年俄国化学家门捷列夫制出第一张元素周期表。元素周期表体现了元素位构性的关系,揭示了元素间的内在联系。下图是元素周期表的一部分,回答下列问题:
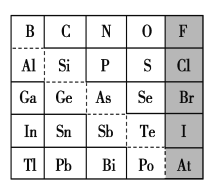
(1)Sn的最高正价为________,Cl的最高价氧化物对应水化物的化学式为________,Bi的最高价氧化物为________。
(2)元素Ga在元素周期表中的位置为:______________。
(3)根据元素周期律,推断:
①阴影部分元素的氢化物热稳定性最高的是________(填化学式)。
②N、O、Al、Si,原子半径大小顺序:___________________
③H3AsO4、H2SeO4、H2SO4的酸性强弱顺序:______________
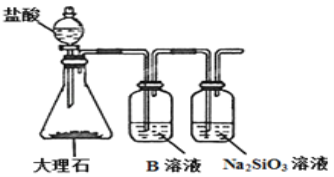
(4)为比较元素C和Si的非金属性强弱,用图所示装置进行实验。溶液B应该选用 ___________溶液,作用是___________________,能说明C和Si非金属性强弱的化学方程式是:________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构如图所示,下列关于该有机物的描述不正确的是
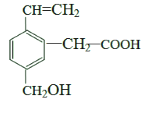
①所有碳原子可能共面;
②能使酸性KMnO4溶液和溴水褪色,且原理相同;
③1mol该有机物分别与足量Na或NaHCO3反应,产生气体在相同条件下体积不相等;
④能发生酯化反应;
⑤能发生加聚反应;
⑥1mol该有机物完全燃烧生成CO2和H2O消耗O2的体积为280 L(标准状况)
A. ①②B. ②⑥C. ③⑥D. ②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用纯净的碳酸钙与稀盐酸反应制取二氧化碳气体,请回答:
(1)实验过程如下图所示,分析判断:________段化学反应速率最快,_______段收集的二氧化碳气体最多。

(2)为了减缓上述反应的速率,欲向溶液中加入下列物质,你认为可行的是(_____)
A.蒸馏水 B.氯化钠固体 C.氯化钠溶液 D.浓盐酸
(3)除了上述方法外,你认为还可以采取哪些措施来减缓化学反应速率?(至少回答两种)_______________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com