
20℃时,11.6g由CO2和H2O组成的混合气体与足量的Na2O2充分反应,固体质量增加3.6g,则原混合气体的平均摩尔质量为(g/mol) ( )
A.5.8 B. 11.6 C. 23.2 D. 46.4
 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案科目:高中化学 来源: 题型:
在含有a g HNO3的稀硝酸中,加入b g铁粉充分反应,铁全部溶解并生成NO,有 g HNO3被还原,则a∶b不可能为 ( )
A.2∶1 B.3∶1 C.4∶1 D.9∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
已知 2Fe3+ +2I- =2Fe2+ +I2 2Fe2+ +Cl2 =2Fe3+ +2Cl- 则有关离子的还原性由强到弱的顺序为 ( )
A.Cl->Fe2+>I- B. Fe2+>I->Cl- C.I->Fe2+>Cl- D.Fe2+>Cl->I-
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)某科研小组研究在恒温、恒容(容器容积为2L)下反应:N2(g)+3H2(g)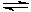 2NH3(g)的变化。初始条件n(H2)=3mol、n(N2)=1mol,反应达到平衡时H2的转化率为60%,NH3的体积分数为a%。
2NH3(g)的变化。初始条件n(H2)=3mol、n(N2)=1mol,反应达到平衡时H2的转化率为60%,NH3的体积分数为a%。
①此条件下反应的平衡常数K=
②若初始条件为n(H2)=n(N2)=0mol、n(NH3)=2.0mol,反应达到平衡时NH3的转化率为
③若初始条件为n(H2)=6mol、n(N2)=2mol,反应达到平衡时NH3的体积分数 a%(填“>”、“<”、或“=”)。
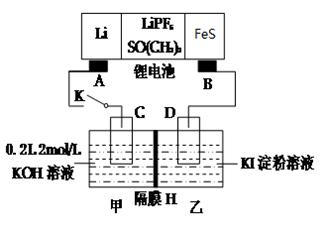
(2)锂电池广泛使用于手表、照相机等电子产品中,具有稳定性好、轻便、环保等优点。右图是以锂电池为电源的电解槽。
①LiPF6作为电池的电解质,可传导Li+导电,已知电池反应为FeS+2Li=Fe+Li2S则A为锂电池的 极,该锂电池的正极反应为 。
②隔膜H为阳离子交换膜,若电解结束后,甲中产生的气体在标准状况下的体积为4.48L,则隔膜H中通过的离子数目为 ,甲中溶液的浓度为 (假设溶液体积不变)。
查看答案和解析>>
科目:高中化学 来源: 题型:
氰气的化学式为(CN)2,它的性质和卤素相似,称为拟卤素,对其性质和有关化合物性质的叙述不正确的是( )
A.NaCN 和AgCN都易溶于水 B.HCl和HCN都易形成白雾
C.MnO2可与HCN反应生成(CN)2
D.(CN)2和NaOH溶液反应生成NaCN、NaCNO和H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
现有一定量的Cu和Fe2O3组成的混合物,平均分成两等分,向其中一份加入2 mol·L-1的盐酸溶液150 mL,恰好完全溶解,所得溶液加入KSCN无血红色出现。若用过量的CO在高温下还原原混合物,固体质量减少为( )
A. 1.6 g B. 2.4 g C. 3.2 g D. 4.8 g
查看答案和解析>>
科目:高中化学 来源: 题型:
现将35g锌粉与少量浓硫酸在加热条件下充分反应,共收集到混合气体11.2L(标准状况),其质量为19.6g,则过剩的锌粉的质量为( )
A.1.0g B.2.0g C.2.5g D.3.5g
查看答案和解析>>
科目:高中化学 来源: 题型:
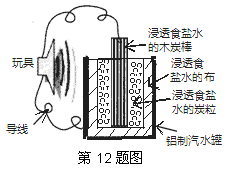 右图是一个用废旧材料制作的可用于驱动玩具的电池示意图,该电池工作时,有关说法正确的是
右图是一个用废旧材料制作的可用于驱动玩具的电池示意图,该电池工作时,有关说法正确的是
A.木炭棒应与玩具电机的负极相连
B.炭粒和炭棒上发生的电极反应是:O2+4e-=2O2-
C.铝罐将逐渐被腐蚀
D.因为一开始反应就会生成大量氯气,该电池有一定
的危险性
查看答案和解析>>
科目:高中化学 来源: 题型:
现用18.4 mol·L-1的浓硫酸配制450mL 0.2 mol·L-1的稀硫酸,可供选择的仪器有:
①玻璃棒 ②烧杯 ③胶头滴管 ④量筒 ⑤托盘天平
(1)上述仪器在配制过程中不需要用到的是__________________。(填序号)除上述仪器外,尚缺最重要的仪器是 。
(2)计算所需浓硫酸的体积为___________mL(保留1位小数)。
(3)实验中用到玻璃棒,其作用分别是:___________、__________。
(4)配制时,一般可分为以下几个步骤:
①量取 ②计算 ③稀释 ④摇匀 ⑤转移 ⑥洗涤 ⑦定容 ⑧冷却。其正确的操作顺序
为:②→①→③→____ →____→____→____→④(填序号)
(5)在配制过程中,下列操作可引起所配溶液浓度偏高的有____________(填序号)
A.用量筒量取浓硫酸时,仰视刻度线取浓硫酸
B.定容时,俯视容量瓶刻度线进行定容
C.将稀释后的硫酸立即转入容量瓶后,紧接着就进行以后的实验操作
D.转移溶液时,不慎有少量溶液洒到容量瓶外面
E.容量瓶用蒸馏水洗涤后未干燥,含有少量蒸馏水
F.定容后,把容量瓶倒置摇匀后发现液面低于刻度线,便补充几滴水至刻度处
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com