
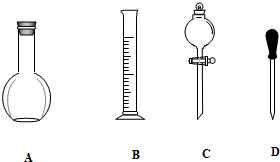
分析 (1)依据配制一定物质的量浓度溶液的一般步骤选择需要仪器,确定用不到的仪器和缺少的仪器;
(2)依据容量瓶构造及使用方法及注意事项解答;
(3)依据配制溶液体积选择合适的容量瓶,依据m=CVM计算需要溶质的质量;定容时仰视刻度线,导致溶液体积偏大,依据C=$\frac{n}{V}$进行误差判断.
解答 解:(1)配制一定物质的量浓度溶液的一般步骤:计算、称量或者量取、溶解或者稀释、移液、洗涤、定容、摇匀,用到的仪器:托盘天平、药匙、量筒、烧杯、玻璃棒、500mL容量瓶、胶头滴管,用不到平底烧瓶和分液漏斗,还缺少的仪器:烧杯、玻璃棒、500mL容量瓶;
故答案为:AC;烧杯、玻璃棒、500mL容量瓶;
(2)A.容量瓶带有瓶塞,使用前应检查是否漏水,故A正确;
B.容量瓶用水洗净后,再用待配溶液洗涤,导致溶质的物质的量偏大,溶液浓度偏高,故B错误;
C.容量瓶为精密仪器,不能用来溶解固体,故C错误;
D.容量瓶为精密仪器,不能用来稀释浓溶液,故D错误;
E.定容后,盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀,故E正确;
故选:BCD;
(3)需要0.1mol/LNaOH溶液450mL,应选择500mL容量瓶,实际配制500mL溶液,需要溶质的质量m=0.1mol/L×40g/mol×0.5L=2.0g;定容时仰视刻度线,导致溶液体积偏大,依据C=$\frac{n}{V}$可知溶液浓度偏低,
故答案为:2.0;小于.
点评 本题考查了一定物质的量浓度溶液的配制及误差分析,明确配制原理和操作步骤是解题关键,注意容量瓶构造及使用方法,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | Na2FeO4消毒、杀菌时得到的Fe3+可以净水,Fe3+能产生净水物质的原因是:Fe3++3H2O?Fe(OH)3(胶体)+3H+ | |
| B. | 工业上可用FeCl3、NaOH、NaClO三种物质反应制得Na2FeO4,化学方程式为:2FeCl3+10NaOH+3NaClO═2 Na2FeO4+9NaCl+5H2O | |
| C. | Na2FeO4在酸性溶液中不稳定,与水反应生成Fe3+和O2,离子方程式为:4FeO42-+10H2O═4Fe3++20OH-+3O2↑ | |
| D. | 工业上可用铁做阳极,电解浓NaOH溶液的方法制Na2FeO4,阳极的电极反应为:Fe-6e-+8OH-═FeO42-+4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
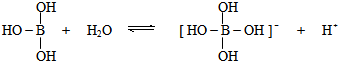 .下列判断正确的是( )
.下列判断正确的是( )| A. | 硼酸是三元酸,抑制水的电离 | |
| B. | 硼酸分子中各原子最外层均达到8电子结构 | |
| C. | 硼酸与NaOH溶液反应的离子方程式:H3BO3+OH-═[B(OH)4]- | |
| D. | 硼酸是两性氢氧化物,也能与强酸溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,其与过量的NaOH溶液反应的化学方程式是
,其与过量的NaOH溶液反应的化学方程式是 +2NaOH→
+2NaOH→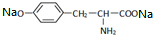 +2H2O.
+2H2O.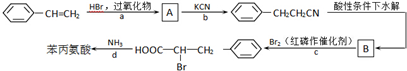
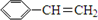 +HBr→
+HBr→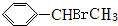 .
. +Br2$\stackrel{红磷}{→}$
+Br2$\stackrel{红磷}{→}$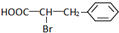 +HBr.
+HBr.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
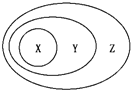
| X | Y | Z | |
| 例 | 氧化物 | 化合物 | 纯净物 |
| A | 溶液 | 分散系 | 混合物 |
| B | 铜 | 金属元素 | 元素 |
| C | 强电解质 | 电解质 | 化合物 |
| D | 置换反应 | 氧化还原反应 | 离子反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
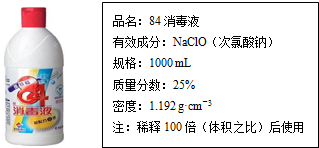
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
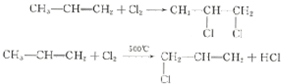
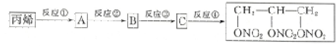
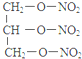 +3H2O.
+3H2O.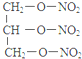 +5O2$\stackrel{酶}{→}$12CO2+10H2O+12NO.
+5O2$\stackrel{酶}{→}$12CO2+10H2O+12NO.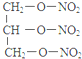 $\stackrel{加热或振动}{→}$12CO2+10H2O+2NO+5N2.
$\stackrel{加热或振动}{→}$12CO2+10H2O+2NO+5N2.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com