
| A. | 50% | B. | 60% | C. | 75% | D. | 86% |
分析 依据化学平衡三段式列式计算,当达到平衡状态时,测得容器中SO2(g)的转化率为60%,则平衡时的浓度为2mol/L×(1-60%)=0.8mol/L,
SO2(g)+NO2(g)?SO3(g)+NO(g)
起始量(mol/L) 2 2 0 0
变化量(mol/L) 1 1 1 1
平衡量(mol/L) 0.8 0.8 1.2 1.2
依据平衡常数概念计算出该反应的平衡常数,依据平衡三段式,结合平衡常数计算SO2的转化率.
解答 解:当达到平衡状态时,测得容器中SO2(g)的转化率为60%,则平衡时的浓度为2mol/L×(1-60%)=0.8mol/L,
SO2(g)+NO2(g)?SO3(g)+NO(g)
起始量(mol/L) 2 2 0 0
变化量(mol/L) 1 1 1 1
平衡量(mol/L) 0.8 0.8 1.2 1.2
所以反应平衡常数K=$\frac{1.2×1.2}{0.8×0.8}$=2.25,答:反应的平衡常数为1;
当SO2(g)和NO2(g)的初始浓度都增大到3mol/L,设消耗二氧化硫浓度为x;
SO2(g)+NO2(g)?SO3(g)+NO(g)
起始量(mol/L) 3 3 0 0
变化量(mol/L) x x x x
平衡量(mol/L) 3-x 3-x x x
平衡常数K=$\frac{x{\;}^{2}}{(3-x)^{2}}$=2.25
x=1.8mol/L
则SO2(g)转化率=$\frac{1.8mol/L}{3mol/L}$×100%=60%,
故选B.
点评 本题考查了化学平衡计算的分析应用,主要是平衡常数、转化率概念的计算应用,掌握基础是关键,题目较简单.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
 A、B、X、Y均为中学阶段的常见物质,它们之间的转化关系如图所示,试写出符合下列条件的化学方程式:
A、B、X、Y均为中学阶段的常见物质,它们之间的转化关系如图所示,试写出符合下列条件的化学方程式:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 15mol、25% | B. | 20mol、75% | C. | 20mol、50% | D. | 40mol、80% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ①④ | C. | ②③ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 在有机物分子中,若碳原子连接四个不同的原子或原子团,该碳原子称为不对称碳原子(或手性碳原子).具有手性碳原子的有机物具有光学活性.八角属于草本植物,主要产于中国和越南,是我国民间常用做烹调的香料.最新医学研究成果显示,从八角中可以提取到莽草酸,它是一种白色晶体,微溶于水,是制取抗禽流感药的基本原料.莽草酸的结构式如图:
在有机物分子中,若碳原子连接四个不同的原子或原子团,该碳原子称为不对称碳原子(或手性碳原子).具有手性碳原子的有机物具有光学活性.八角属于草本植物,主要产于中国和越南,是我国民间常用做烹调的香料.最新医学研究成果显示,从八角中可以提取到莽草酸,它是一种白色晶体,微溶于水,是制取抗禽流感药的基本原料.莽草酸的结构式如图: $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$ +H2O.
+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶解度(s) | B. | 物质的量浓度(c) | C. | 质量分数(w) | D. | 摩尔质量(M) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
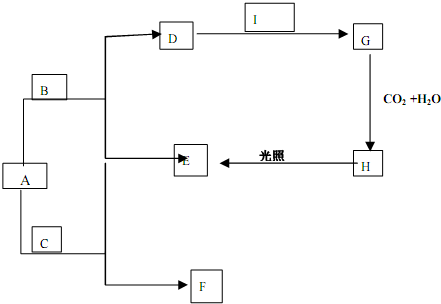
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的标准燃烧热为-890.3kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)?CO2(g)+2H2O(g)△H=-890.3kJ•mol-1 | |
| B. | 500℃、30MPa下,0.5mol N2和1.5molH2置于密闭容器中充分反应生成氨气,放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-38.6kJ•mol-1 | |
| C. | 在100℃、101 kPa条件下,液态水的气化热为40.69 kJ•mol-1,则H2O(g)?H2O(l) 的△H=+40.69 kJ•mol-1 | |
| D. | 酸碱发生中和反应生成1mol液态H2O时,所放出的热量称为中和热,可表示为:H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com