
| A. | CuSO4溶液 | B. | 盐酸 | C. | NaOH溶液 | D. | Ba(OH)2溶液 |
分析 只用一种试剂就能将NH4Cl、K2SO4、(NH4)2SO4三种化肥区分开来,则所取的试剂与这三种物质混合时须有明显的不同现象,硫酸根离子常用钡离子鉴别,铵根离子用氢氧根离子鉴别,K+常用焰色反应,但这是物理方法,氯离子常用硝酸银溶液鉴别.
解答 解:A.CuSO4溶液与这三种溶液均不发生反应,溶液均变为蓝色,无其它明显现象,故A错误;
B.K2SO4、(NH4)2SO4、NH4Cl三种溶液分别与盐酸混合后均无明显现象,所以无法鉴别,故B错误;
C.氢氧化钠溶液能与硫酸铵溶液以及氯化铵溶液产生有刺激气味的气体,现象相同,无法鉴别,故C错误;
D.氢氧化钡溶液与硫酸钾溶液反应生成白色沉淀,与硫酸铵溶液反应生成白色沉淀和刺激性气味的气体,与氯化铵溶液反应生成刺激性气味的气体,所以现象不同,可以鉴别,故D正确;
故选:D.
点评 本题考查了常见物质的鉴别,进行物质的鉴别时,所选的试剂与待鉴别物质混合必须有明显不同的反应现象


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若a=b,pH(NaX)>pH(NaY),则酸性:HX>HY | |
| B. | 若a=b,并测得c(X-)=c(HY)+c(Y-),则HX是强酸 | |
| C. | 若a>b,c(X-)=c(Y-),可推出酸性:HX>HY | |
| D. | 若两溶液等体积混合,测得c(X-)+c(HX)+c(HY)+c(Y-)=0.1mol•L-1,则可求得a=b=0.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
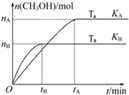 一定条件下,在容积为3L的密闭容器中加入1molCO和2molH2发生反应:CO(g)+2H2(g)?CH3OH(g)△H,达平衡状态.根据图示回答:
一定条件下,在容积为3L的密闭容器中加入1molCO和2molH2发生反应:CO(g)+2H2(g)?CH3OH(g)△H,达平衡状态.根据图示回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 Ⅰ.t℃时,将2mol SO2和1mol O2通入体积为2L的恒温恒容密闭容器中,发生如下反应:
Ⅰ.t℃时,将2mol SO2和1mol O2通入体积为2L的恒温恒容密闭容器中,发生如下反应:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 373K时,某 2L密闭容器中加入2mol NH3发生如下可逆反应:2NH3(g)?N2(g)+3H2(g).其中物质H2的物质的量变化如图所示.
373K时,某 2L密闭容器中加入2mol NH3发生如下可逆反应:2NH3(g)?N2(g)+3H2(g).其中物质H2的物质的量变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的燃烧热△H=-890.3kJ/mol,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ/mol | |
| B. | 一定条件下,将0.5 mol N2和1.5 molH2置于密闭容器中充分反应生成NH3放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ/mol | |
| C. | 在101kPa时,2gH2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ/mol | |
| D. | HCl和NaOH反应的中和热△H=-57.3 kJ/mol,则H2SO4和Ba(OH)2反应的中和热△H=2×(-57.3)kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO2和N2O4的混合气体中,NO2的体积分数是80% | |
| B. | 该浓硝酸中HNO3的物质的量浓度是14.0mol/L | |
| C. | 该合金中铜与镁的物质的量之比是2:1 | |
| D. | 得到2.54g沉淀时,加入NaOH溶液的体积是600mL |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com