
| A. | 含有的中子数为a+b | B. | 含有的电子数为a-n | ||
| C. | 质量数为a+b+n | D. | 1mol该原子的质量约为bg |
分析 根据abXn-中质子数是a,质量数是b,中子数=质量数-质子数,阴离子中核外电子数=核内质子数+电荷数,该微粒的相对原子质量约等于其质量数,而摩尔质量在数值上等于该微粒的相对原子质量.
解答 解:A、该微粒中中子数=质量数-质子数=b-a,故A错误;
B、该微粒的核外电子数=核内质子数+电荷数=a+n,故B错误;
C、该微粒的质量数为b,故C错误;
D、该原子的相对原子质量约等于其质量数,即为b,而摩尔质量在数值上等于相对分子质量,即为bg/mol,故1mol该原子的质量为m=nM=1mol×bg/mol=bg,故D正确.
故选D.
点评 本题考查了质子数、质量数和中子数之间的关系,难度不大,明确阴阳离子核外电子数的计算方法.


科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
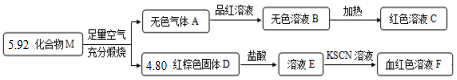
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 序号 | 实验操作 | 实验现象 | 实验结论 |
| A | 向某无色溶液中滴加盐酸 | 产生能使澄清石灰水变浑浊气体 | 说明溶液中一定含有CO32- |
| B | 向某无色溶液中滴加盐酸酸化的BaCl2溶液 | 产生白色沉淀 | 说明溶液中一定含有SO42- |
| C | 向某溶液中先滴加KSCN溶液,再滴加氯水 | 先无明显现象,后出现血红色溶液 | 说明溶液中一定含有Fe2+ |
| D | 向一定浓度的Na2SiO3溶液中通入适量的CO2 | 出现白色沉淀 | 说明H2CO3的酸性比H2SiO3强 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 标况下,燃烧1mol S放出的热量为297.23 kJ | |
| B. | S ( g )+O2 ( g )=SO2 ( g ) 放出的热量大于297.23 kJ | |
| C. | S ( g )+O2 ( g )=SO2 ( g ) 放出的热量小于297.23 kJ | |
| D. | 形成1 mol SO2 的化学键所释放的总能量大于断裂 1 molS ( s )和 1mol O2 ( g )的化学键所吸收的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
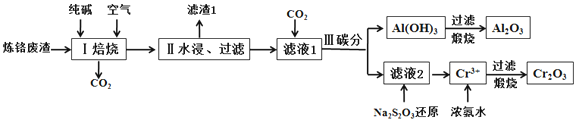
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠投入到硫酸铜的溶液中不能置换得到铜单质 | |
| B. | 金属钠着火燃烧时,可以用水灭火 | |
| C. | 铝比铁活泼,所以铝比铁更容易被腐蚀 | |
| D. | 正常雨水PH等于7,酸雨的PH小于7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸和硝酸是重要的工业原料,工业上可用于制化肥、农药、和炸药 | |
| B. | 石英砂可以用于制取高纯度的硅,硅是将太阳能转化为电能的常用材料 | |
| C. | 因为氨易液化,在汽化时会吸收大量的热量,所以可作制冷剂 | |
| D. | SO2和氯水遇到紫色石蕊试液都先变红后褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇的沸点高于丙烷 | |
| B. | 油脂和蛋白质都是高分子化合物 | |
| C. | CH2=C(CH3)2的名称是2-甲基-2-丙烯 | |
| D. | 对二甲苯的核磁共振氢谱有4个吸收峰 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com