
| ||
| ||


科目:高中化学 来源: 题型:阅读理解

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
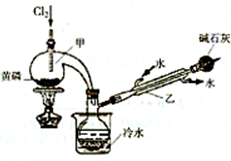
| 熔点/℃ | 沸点/℃ | 密度/g?mL | 其他 | |||||||||
| 黄磷 | 44.1 | 280.5 | 1.82 | 2P(过量)+3Cl2
2P+5Cl2(过量)
| ||||||||
| PCl3 | -112 | 75.5 | 1.574 | 遇水生成H3PO3和HCl,遇O2生成POCl3 | ||||||||
| POCl3 | 2 | 105.3 | 1.675 | 遇水生成H3PO4和HCl,能溶于 PCl3 |
| ||
| ||
(c1V1-
| ||
| m |
(c1V1-
| ||
| m |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| A、同温同压下制得相同体积的Cl2时,三个反应中被氧化的HCl的物质的量相同 |
| B、同温同压下制得相同体积的Cl2时,三个反应中电子转移的总数相等 |
| C、同温同压下制得相同体积的Cl2时,三个反应中消耗的氧化剂的物质的量相同 |
| D、同温同压下制得相同体积的Cl2时,三个反应中被氧化的氯原子数不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
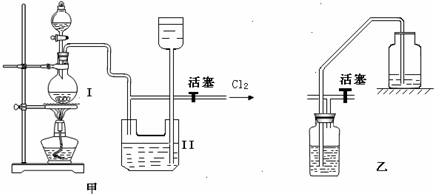
实验室制备Cl2时,反应物即使在停止加热后还会继续反应一段时间,当要收集多瓶Cl2时,常有较多的Cl2逸散。为了防止多余的Cl2逸散到空气中,并使Cl2 随时取用,有人设计了如图甲装置来制取Cl2。
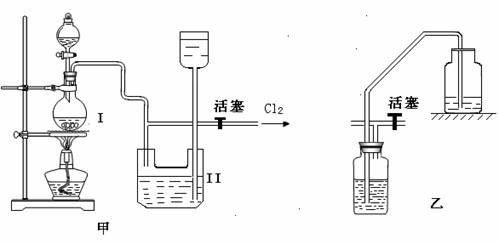
⑴甲装置Ⅱ是利用 原理设计的。当关闭活塞时,产生的氯气将Ⅱ中下方容器内的液体 ,这样既可达到 目的,又可防止多余的Cl2逸散到空气中,从而使装置达到随时取用Cl2的目的。
⑵甲装置Ⅱ中盛有的液体是 。
⑶甲装置Ⅱ_____(填“能”或“不能”)用乙装置来代替。
⑷甲装置Ⅰ中反应的化学方程式为 。
⑸实验室多余Cl2用 吸收,反应的离子方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com