
| A. | 锌 | B. | 铁 | C. | 镁 | D. | 铝 |
分析 标况下22.4L氢气的物质的量为:$\frac{22.4L}{22.4L/mol}$=1mol,故20g金属提供的电子为1mol×2=2mol,结合化合价计算提供1mol电子需要各金属的质量,混合各组分的质量满足都等于10g或满足有的组分小于10g、有的组分大于10g,据此判断.
解答 解:标况下22.4L氢气的物质的量为:$\frac{22.4L}{22.4L/mol}$=1mol,故20g金属提供的电子为1mol×2=2mol,则提供1mol电子需要金属的质量为10g,
A.Zn在反应中表现+2价,提供1mol电子需要Zn的质量为65g/mol×$\frac{1mol}{2}$=32.5g;
B.Fe在反应中表现+2价,提供1mol电子需要Fe的质量为56g/mol×$\frac{1mol}{2}$=28g;
C.Mg在反应中表现+2价,提供1mol电子需要Mg的质量为24g/mol×$\frac{1mol}{2}$=12g;
D.Al在反应中表现+3价,提供1mol电子需要Al的质量为27g/mol×$\frac{1mol}{3}$=9g;
提供1mol电子,只有Al的质量小于10g,其它金属的质量都大于10g,故金属混合物中一定有Al,
故选D.
点评 本题考查了混合物反应的计算,题目难度中等,明确发生反应的实质为解答关键,注意掌握平均值法在化学计算中的应用,试题培养了学生的分析能力及化学计算能力.


 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案科目:高中化学 来源: 题型:选择题
| A. | 煤经过气化和液化等物理变化可以转化为清洁燃料 | |
| B. | Al2(SO4)3可用于对自来水进行消毒 | |
| C. | 大型制冷设备的液氨大量泄漏不会对操作人员有损害 | |
| D. | 静电除尘与胶体性质相关 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32- | |
| B. | 加入氯化钡溶液有白色沉淀产生,再加入盐酸,沉淀不消失,一定有SO42- | |
| C. | 加入氢氧化钠溶液并加热,产生的气体能使湿润的红色石蕊试纸变蓝,一定有NH4+ | |
| D. | 加入碳酸钠溶液产生白色沉淀,再加入盐酸白色沉淀消失,一定有Ca2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
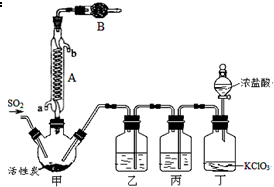 硫酰氯(SO2Cl2)常作氯化剂或氯磺化剂,用于制作药品、染料、表面活性剂等.有关物质的部分性质如表:
硫酰氯(SO2Cl2)常作氯化剂或氯磺化剂,用于制作药品、染料、表面活性剂等.有关物质的部分性质如表:| 物质 | 熔点/℃ | 沸点/℃ | 其它性质 |
| SO2Cl2 | -54.1 | 69.1 | ①易水解,产生大量白雾 ②易分解:SO2Cl2$\frac{\underline{\;100℃\;}}{\;}$SO2↑+Cl2↑ |
| H2SO4 | 10.4 | 338 | 吸水性且不易分解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属阳离子与自由电子间的作用较弱 | |
| B. | 金属在外加电场作用下可失去电子 | |
| C. | 金属阳离子在外加电场作用下可发生定向移动 | |
| D. | 自由电子在外加电场作用下可发生定向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ①④ | C. | ②③ | D. | ②⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com