
已知33As、35Br位于同一周期。下列关系正确的是 ( )
| A.原子半径:As>Cl>P |
| B.热稳定性:HCl>AsH3>HBr |
| C.还原性:As3->S2->Cl- |
| D.酸性:H3AsO4>H2SO4>H3PO4 |
 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:单选题
下列所述变化规律正确的是
| A.Na、Mg、Al还原性依次增强 |
| B.HCl、PH3、H2S稳定性依次减弱 |
| C.NaOH、KOH、CsOH碱性依次增强 |
| D.S2-、Cl-、K+、Ca2+离子半径依次增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
周期表中前20号元素X、Y、Z。已知:X+和Y-两种离子具有相同的电子层结构;Z元素原子核·内质子数比Y元素原子核内质子数少9个,Y和Z两元素可以形成含有42个电子的负一价阴离子。下列有关说法正确的是
| A.离子半径:X+ >Y- |
| B.Z元素的最高正化合价与最低负化合价代数和为4 |
| C.X、Y、Z可以形成XYZ、XYZ3、XYZ4等化合物 |
| D.Y的氢化物中存在离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
几种短周期元素的原子半径及主要化合价如下表:
| 元素代号 | X | Y | Z | M | R | Q | |
| 原子半径(×10-10 m) | 1.86 | 0.99 | 1.43 | 1.60 | 0.75 | 0.74 | |
| 主要化合价 | 最高正价 | +1 | +7 | +3 | +2 | +5 | —— |
| 最低负价 | —— | -1 | —— | ——- | -3 | -2 | |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
Se是人体必需的微量元素,下列有关 和
和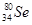 的说法正确的是( )
的说法正确的是( )
A. 和 和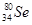 的核外电子数不同 的核外电子数不同 |
B. 和 和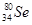 的中子数分别为78和80 的中子数分别为78和80 |
C. 和 和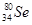 的质量数不同,是同种元素 的质量数不同,是同种元素 |
D. 和 和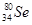 的质子数相同,是同一种核素 的质子数相同,是同一种核素 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
A元素的阳离子与B元素的阴离子具有相同的电子层结构,关于两元素有以下叙述:①原子半径A<B;②离子半径A>B;③原子序数A>B;④原子最外层电子数A<B;⑤A的正化合价与B的负化合价的绝对值一定相等。其中正确的是 ( )
| A.①② | B.③④ | C.③⑤ | D.③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
元素周期律产生的根本原因就是随着元素原子序数的递增
| A.元素的相对原子质量逐渐增大 |
| B.核外电子排布呈周期性变化 |
| C.原子半径呈周期性变化 |
| D.元素主要化合价呈周期性变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
不能说明X的电负性比Y的电负性大的是( )。
| A.与H2化合时X单质比Y单质容易 |
| B.X的最高价氧化物的水化物的酸性比Y的最高价氧化物的水化物的酸性强 |
| C.X原子的最外层电子数比Y原子最外层电子数多 |
| D.X单质可以把Y从其氢化物中置换出来 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
关于原子模型的演变过程,正确的是( )。
| A.汤姆逊原子模型→道尔顿原子模型→卢瑟福原子模型→玻尔原子模型→量子力学模型 |
| B.汤姆逊原子模型→卢瑟福原子模型→玻尔原子模型→量子力学模型→道尔顿原子模型 |
| C.道尔顿原子模型→卢瑟福原子模型→汤姆逊原子模型→玻尔原子模型→量子力学模型 |
| D.道尔顿原子模型→汤姆逊原子模型→卢瑟福原子模型→玻尔原子模型→量子力学模型 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com