
【题目】抗血栓药物氯贝丁酯(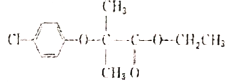 )的一种合成路线如下图,部分反应条件及部分反应物、生成物已略去。
)的一种合成路线如下图,部分反应条件及部分反应物、生成物已略去。
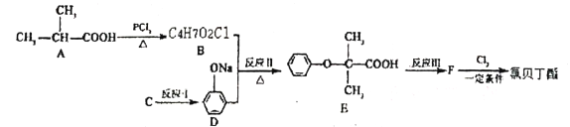
回答下列问题:
(1)E中官能团的名称为___________。
(2)有机物A的化学名称为___________,B的结构简式为___________,反应Ⅱ的反应类型为___________。
(3)要实现反应I的转化,加入下列物质能达到目的的是___________。
A. NaHCO. B NaOH C. Na2CO3 D. CH3COONa
(4)写出反应Ⅲ的化学方程式_________________________________。
(5)产物E有多种同分异构体,满足下列条件的所有同分异构体G有___________种。
①属于酯类且与FeCl3溶液显紫色:②能发生银镜反应;③1molG最多与2 molNaOH反应;④苯环上只有2个取代基且处于对位。
(6)结合以上合成路线信息,设计以 CH3CH2 COOH为原料(无机试剂任选),合成有机物 的合成路线_______________________________。
的合成路线_______________________________。
【答案】羧基、醚键 2-甲基丙酸 ![]() 取代反应 bc
取代反应 bc ![]()
![]() 5
5 ![]()
![]()
【解析】
C发生反应Ⅰ生成苯酚钠,说明C为苯酚,B与D发生取代反应生成E,由E的结构可知,B为(CH3)2CClCOOH,由氯贝丁酯( )的结构可知F为
)的结构可知F为 ,则反应Ⅲ为E与乙醇的酯化反应,据此答题。
,则反应Ⅲ为E与乙醇的酯化反应,据此答题。
(1)E的结构简式为: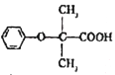 ,含有的官能团为羧基、醚键,故答案为:羧基、醚键。
,含有的官能团为羧基、醚键,故答案为:羧基、醚键。
(2)有机物A![]() 的化学名称为2-甲基丙酸,B的结构简式为
的化学名称为2-甲基丙酸,B的结构简式为![]() ,反应Ⅱ为取代反应,故答案为:2-甲基丙酸;
,反应Ⅱ为取代反应,故答案为:2-甲基丙酸;![]() ;取代反应。
;取代反应。
(3)反应Ⅰ为苯酚生成苯酚钠的反应。
a.苯酚的酸性比碳酸弱,与NaHCO3不能反应,故a错误;
b.苯酚显酸性,与NaOH可以反应生成苯酚钠,故b正确;
c.苯酚的酸性比碳酸氢钠强,可以与Na2CO3反应生成苯酚钠,故c正确;
d.苯酚的酸性比乙酸弱,与CH3COONa不反应,故d错误。
故答案为:bc。
(4)反应Ⅲ是酯化反应,反应的化学方程式为: ![]()
![]() ,故答案为:
,故答案为:![]()
![]() 。
。
(5)产物E为 ,①属于酯类且与FeCl3溶液显紫色,说明含有酚羟基;②能发生银镜反应,说明属于甲酸酯类;③1molG最多与2molNaOH反应,说明不能甲酸苯酚酯;④苯环上只有2个取代基且处于对位,满足条件的同分异构体:其中1个侧链为羟基,另一侧链为HCOOC3H7-,HCOOC3H7-的结构有5种:HCOOCH2CH2CH2-,HCOOCH2CH(CH3)-,HCOOCH(CH3)CH2-,HCOOC(CH3)2-,HCOOCH(CH2CH3)-,因此G有5种,故答案为:5。
,①属于酯类且与FeCl3溶液显紫色,说明含有酚羟基;②能发生银镜反应,说明属于甲酸酯类;③1molG最多与2molNaOH反应,说明不能甲酸苯酚酯;④苯环上只有2个取代基且处于对位,满足条件的同分异构体:其中1个侧链为羟基,另一侧链为HCOOC3H7-,HCOOC3H7-的结构有5种:HCOOCH2CH2CH2-,HCOOCH2CH(CH3)-,HCOOCH(CH3)CH2-,HCOOC(CH3)2-,HCOOCH(CH2CH3)-,因此G有5种,故答案为:5。
(6)以CH3CH2COOH为原料合成有机物![]() ,需要合成CH2=CHCOOH,根据题干流程图中A→B,可以首先实现
,需要合成CH2=CHCOOH,根据题干流程图中A→B,可以首先实现![]() 的转化,再将
的转化,再将![]() 中的氯离子消去生成CH2=CHCOONa,最后酸化即可,合成路线为:
中的氯离子消去生成CH2=CHCOONa,最后酸化即可,合成路线为:![]()
![]() ,
,
故答案为:![]()
![]() 。
。


科目:高中化学 来源: 题型:
【题目】在密闭容中发生下列反应aA(g)![]() cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
A. A的转化率变小 B. 平衡向正反应方向移动
C. D的体积分数变大 D. a> c+d
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】前国际空间站处理CO2废气涉及的反应为CO2+4H2 ![]() CH4+2H2O。该反应的下列说法正确的是
CH4+2H2O。该反应的下列说法正确的是
A. 通过使用钌催化剂能使CO2 100%转化为CH4
B. 该温度下,当反应达平衡时,CH4物质的量就不再变化,因为反应已经停止
C. 除了使用催化剂,升高温度或增大压强都能加快该反应的速率
D. 由于升高温度可以加快反应速率,所以在工业生产中该反应温度越高越好
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2S2O4俗称保险粉,常用做纺织工业的漂白剂、脱色剂等。某科研小组制备并探究其性质。
资料:Na2S2O4易溶于水,具有极强的还原性,易被空气氧化,在碱性介质中稳定。
Ⅰ.制备Na2S2O4 (部分加热等辅助仪器略去)
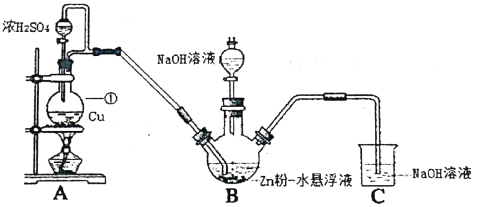
(1)仪器①的名称是___________。
(2)B装置用于制备Na2S2O4。第一步反应:Zn+2SO2![]() ZnS2O4;第二步,加入NaOH溶液,于28~35℃下反应生成Na2S2O4,该步反应的化学方程式为___________。
ZnS2O4;第二步,加入NaOH溶液,于28~35℃下反应生成Na2S2O4,该步反应的化学方程式为___________。
(3)实验时,先向B中通入SO2的原因,除产生Zn S2O4之外,另一原因是___________。
(4)反应后除去B中的沉淀,在滤液中加入一定量的NaCl固体搅拌,有Na2S2O4晶体析出。加入NaCl固体的作用是___________
Ⅱ.探究Na2S2O4的性质
(5)隔绝空气加热Na2S2O4固体完全分解得到固体产物Na2SO3、Na2S2O3和SO2,但科研小组没有做到完全隔绝空气,得到的固体产物中还含有Na2SO4。请设计实验证明该分解产物中含有Na2SO4。实验方案是___________。(可选试剂:稀盐酸、稀硫酸、稀硝酸、BaCl2溶液、AgNO3溶液、KMnO4,溶液)
(6)制备纳米级银粉用NaOH溶液溶解Na2S2O4,加入一定量的AgNO3溶液,生成纳米级的银粉。在制备银粉的反应中,氧化剂和还原剂的物质的量之比为2:1,且生成的含硫物质只有一种,写出该反应的离子方程式___________。
(7)为测定某含硫代硫酸钠样品的纯度(其它杂质均不参加反应)设计如下方案,并进行实验:
①准确称取该硫代硫酸钠样品mg,配制成250mL待测溶液。
②移取25.00mL待测溶液于锥形瓶中,加入少量淀粉溶液,用 nmol·L-1I2标准溶液滴定(发生反应:2S2O32-+I2=S4O32-+2I-),至滴定终点。
③滴定终点的现象为___________,平均消耗I2标准溶液VmL,样品中Na2S2O4的纯度为___________(用代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制备纯硅反应的热化学方程式:SiCl4(g)+2H2(g) ![]() Si(s)+4HCl(g) ΔH=+Q kJ·mol-1(Q>0)。某温度、压强下,将一定量的反应物通入密闭容器中进行以上反应(此条件下为可逆反应),下列叙述正确的是
Si(s)+4HCl(g) ΔH=+Q kJ·mol-1(Q>0)。某温度、压强下,将一定量的反应物通入密闭容器中进行以上反应(此条件下为可逆反应),下列叙述正确的是
A. 反应过程中,若增大压强能提高SiCl4的转化率
B. 若反应开始时SiCl4为1 mol,则达到平衡时,吸收热量为Q kJ
C. 当反应吸收热量为0.025Q kJ时,生成的HCl通入100 mL 1 mol·L-1的NaOH溶液中恰好反应
D. 反应至4 min时,若HCl浓度为0.12 mol/L,则H2的反应速率为0.03 mol/( L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气的治理是减轻空气污染的有效途径。科学家研究发现TiO2的混凝土或沥青可以适度消除汽车尾气中的氮氧化物,其原理如下。下列关于“消除”过程的叙述错误的是
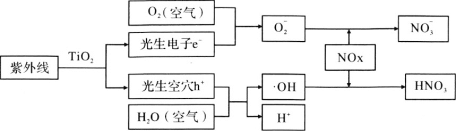
A. 部分光能转变为化学能
B. 消除总反应为:4NOx+(5-2x)O2+2H2O![]() 4HNO3
4HNO3
C. 使用纳米TiO2,产生的光生电子和空穴更多,NOx消除效率更高
D. 1 mol![]() 比1 mol羟基(·OH)多9NA个电子(NA为阿伏伽德罗常数)
比1 mol羟基(·OH)多9NA个电子(NA为阿伏伽德罗常数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨在工农业生产中应用广泛。在压强为30 MPa时,合成氨平衡混合气体中NH3的体积分数如下:
温度/℃ | 200 | 300 | 400 | 500 | 600 |
氨含量/% | 89.9 | 71.0 | 47.0 | 26.4 | 13.8 |
请回答:
(1)根据表中数据,结合化学平衡移动原理,说明合成氨反应是放热反应的原因是__________________________________________________。
(2)根据下图,合成氨的热化学方程式是__________________________。
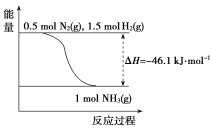
(3)取1 mol N2(g)和3 mol H2(g)放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量________92.2 kJ(填“大于”“等于”或“小于”),原因是________________________;若加入催化剂,ΔH________(填“变大”“变小”或“不变”)。
(4)已知:分别破坏1 mol N≡N键、1 mol H—H键需要吸收的能量为:946 kJ、436 kJ,则破坏1 mol N—H键需要吸收的能量为________kJ。
(5)N2H4可视为:NH3分子中的H被—NH2取代的产物。发射卫星用N2H4(g)为燃料,NO2为氧化剂生成N2和H2O(g)。
已知:N2(g)+2O2(g)===2NO2(g) ΔH1=+67.7 kJ·mol-1
N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH2=-534 kJ·mol-1。
则:1 mol N2H4与NO2完全反应的热化学方程式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸溶液中存在电离平衡CH3COOH![]() H++CH3COO-,下列叙述不正确的是
H++CH3COO-,下列叙述不正确的是
A. 升高温度,平衡正向移动,醋酸的电离常数Ka值增大
B. 0.l0mol/L的CH3COOH溶液中加水稀释,溶液中c(OH-)增大
C. CH3COOH溶液中加少量的CH3COONa固体,平衡逆向移动
D. 室温下,欲使0.1mol/L醋酸溶液的pH,电离度a都减小,可加入少量水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值, 下列叙述正确的是
A. 1mol H2O中含有的极性共价键数目为2NA
B. 16 g16O2和18O2混合物中含有的质子数目为8NA
C. Zn和浓硫酸反应得到22.4LSO2和 H2混合气体时, 转移的电子数为4NA
D. 标准状况下2 mol NO与1 mol O2充分反应后分子数共2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com