
高铁酸钠(Na2FeO4)具有很强的氧化性,是一种新型的绿色净水消毒剂。工业上可以通过次氯酸钠氧化法制备高铁酸钠,生产过程如下:
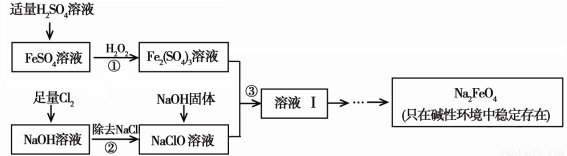

(1)高铁酸钠中铁元素的化合价为 ,次氯酸钠的电子式是________。
(2)步骤①反应的离子方程式是 。
(3)从溶液I中分离出Na2FeO4后,还有副产品Na2SO4 、NaCl,则步骤③中反应的离子方程式为 。
(4)工业上还可用电解浓NaOH溶液的方法制Na2FeO4,其工作原理如图所示:
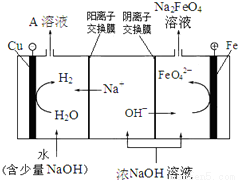
阳极的电极反应式为 。可循环使用的物质是 。
(5)计算Na2FeO4的消毒效率(以单位质量得到的电子数表示)约是氯气的________倍,
科目:高中化学 来源:2016-2017学年江西省宜春市高二上月考二化学卷(解析版) 题型:选择题
未来新能源的特点是资源丰富,在使用时对环境无污染或者污染很小,且可以再生。下列属于未来新能源标准的是
①天然气 ②生物质能 ③潮汐能 ④石油 ⑤太阳能 ⑥煤 ⑦风能 ⑧氢能
A.①②③④ B.⑤⑥⑦⑧ C.③④⑤⑥⑦⑧ D.②③⑤⑦⑧
查看答案和解析>>
科目:高中化学 来源:2016-2017学年贵州省高一上期中化学卷(解析版) 题型:选择题
下列各组离子在水溶液中能够大量共存的是( )
A.Ba2+、Cl-、NO3-、Ca2+ B.H+、Na+、SO42-、CO32-
C.Cu2+、K+、Cl--、OH- D.Ca2+、Na+、CO32、Cl-
查看答案和解析>>
科目:高中化学 来源:2016-2017学年贵州省高二上期中化学卷(解析版) 题型:选择题
一定条件下,固定容积的密闭容器中,CO和H2反应生成甲醇:CO(g)+2H2(g)  CH3OH(g)。如图是该反应在不同温度下CO的转化率随时间变化的曲线。下列判断正确的是 ( )
CH3OH(g)。如图是该反应在不同温度下CO的转化率随时间变化的曲线。下列判断正确的是 ( )
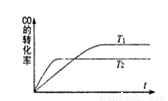
A.T1>T2
B.该反应的△H >0
C.T1时的平衡常数K1> T2时的平衡常数K2
D.T1时的平衡常数K1< T2时的平衡常数K2
查看答案和解析>>
科目:高中化学 来源:2016-2017学年贵州省高二上期中化学卷(解析版) 题型:选择题
已知HCN(aq)与NaOH(aq)反应生成1 mol正盐的ΔH=-12.1 kJ/mol;强酸、强碱的稀溶液反应的中和热ΔH=-57.3 kJ·mol-1。则HCN在水溶液中电离的ΔH等于( )
A.-69.4 kJ·mol-1 B.-45.2 kJ·mol-1
C.+69.4 kJ·m ol-1 D.+45.2 kJ·mol-1
ol-1 D.+45.2 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2017届湖南省长株潭岳益五市十校高三12月联考化学卷(解析版) 题型:选择题
根据下列有关实验得出的结论一定正确的是( )
选项 | 方法 | 结论 |
A | 同温时,等质量的锌粒分别与足量稀硫酸反应 | 产生氢气量:加过胆矾=没加胆矾 |
B | 向Fe(NO3)2溶液中滴入用硫酸酸化的H2O2溶液,则溶液变黄 | 氧化性:H2O2>Fe3+ |
C | 相同温度下,等质量的大理石与等体积、等浓度的盐酸反应 | 反应速率:粉状大理石>块状大理石 |
D | 向2mL 0.1mol•L﹣1Na2S溶液中滴入几滴0.1mol•L﹣1ZnSO4溶液,有白色沉淀生成;再加入几滴0.1mol•L﹣1 CuSO4溶液,则又有黑色沉淀生成 | 溶度积(Ksp):ZnS>CuS |
查看答案和解析>>
科目:高中化学 来源:2017届湖南省长株潭岳益五市十校高三12月联考化学卷(解析版) 题型:选择题
下列关于有机物同分异构体的说法正确的是( )
A.C4H10的二氯取代物有4种
B.最简式为C2H5的烃结构简式有5种
C.乙苯的一氯 取代物只有3种
取代物只有3种
D.分子式为C4H10O且与钠反应的有机物有4种
查看答案和解析>>
科目:高中化学 来源:2017届安徽省培优联盟高三冬季联赛化学试卷(解析版) 题型:填空题
【化学一选修3:物质结构与性质】
铜也是日常生活中常见的金属,它的单质及化合物在科学研究和工农业生产中具有广泛的用途。请回答以下问題:
(1)超细铜粉可用作导电材料、傕化剂等,制备方法如下:
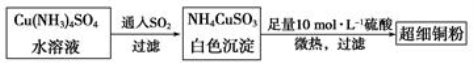
写出基态Cu的外围电子排布式________________,铜元素位于周期表中笫______________族;NH4CuSO3所含元素中第一电离能最大是____________(填元素符号)。
SO42-中心原子的杂化方式为___________,SO32-的空间构型为__________。
③ 将NH4CuSO3溶于足量稀硫酸中,有剌激性气味的气体放出,该气体是__________,所得溶液呈__________色。
(2)某学生向CuSO4浓液中加入少量氨水生成蓝色沉淀,继续加入过量氨水沉淀溶解,得到 深蓝色透明溶液,最后向该溶液中加入一定量乙醇,析出[Cu(NH3)4]SO4 • H2O晶体。
①下列说法正确的是_______(填代号)
A.氨气极易溶于水,是因为NH3和H2O之间形成了极性共价键
B.NH3和H2O中心原子的杂化方式相同,键角也相同
c.Cu(NH3)4SO4所含的化学键有离子键、极性键和配位键
d.[Cu(NH3)4]SO4中配离子的空间构型为正方形
②请解释加入乙醇后析出晶体的原因________________。
(3)Cu晶体的堆积方式如右图所示,设Cu原子半径为a,晶体中Cu原子的配位数为______________,晶体的空间利用率为________________。(已知: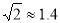 ,列式并计算出结果)
,列式并计算出结果)

查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省分校高二上期中化学卷(解析版) 题型:选择题
室温下,一气态烃与过量氧气混合完全燃烧,恢复到室温,使燃烧产物通过浓硫酸,体积比反应前减少50mL,再通过NaOH溶液,体积又减少了40mL,原烃的分子式是( )
A.CH4 B.C4H10 C.C2H6 D.C3H8
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com