
| A. | 原子半径:Al>Mg>Na | B. | 热稳定性:HF>H2O>NH3 | ||
| C. | 酸性:HClO4>H2SO4>H2PO4 | D. | 金属性:Na>Mg>Al |
分析 A.同周期自左到右,原子半径逐渐减小;
B.元素非金属性越强,气态氢化物越稳定;
C.元素非金属性越强,最高价氧化物对应水化物的酸性越强;
D.同周期自左到右,金属性逐渐减弱.
解答 解:A.同周期自左到右,原子半径逐渐减小,因此原子半径Al<Mg<Na,故A错误;
B.非金属性F>O>N,因此热稳定性HF>H2O>NH3,故B正确;
C.非金属性Cl>S>P,因此酸性HClO4>H2SO4>H3PO4,故C正确;
D.同周期自左到右,金属性逐渐减弱,因此金属性Na>Mg>Al,故D正确;
故选A.
点评 本题考查了元素周期律的知识,难度不大,重点掌握元素非金属性和金属性强弱的判断依据.


科目:高中化学 来源: 题型:选择题
| 盐酸的体积/mL | 50 | 50 | 50 |
| 混合物的质量/g | 9.2 | 15.7 | 27.6 |
| CO2的体积(标准 状况下)/L | 2.24 | 3.36 | 3.36 |
| A. | 盐酸的物质的量浓度为3.0 mol•L-1 | |
| B. | 根据表中数据能计算出混合物中NaHCO3的质量分数为45.65% | |
| C. | 加入混合物9.2 g时盐酸过量 | |
| D. | 15.7 g混合物恰好与盐酸完全反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨分子的电子式: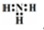 | |
| B. | 质子数为17、中子数为20的氯原子:${\;}_{17}^{20}$Cl | |
| C. | O2-的结构示意图为: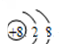 | |
| D. | ${\;}_{35}^{79}$Br的基态原子电子排布式:[Ar]4S24P5 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 物质 | 除杂试剂 | 分离方法 | |
| A | 碳酸氢钠(碳酸钠) | - | 加热 |
| B | 二氧化碳(氯化氢) | 饱和Na2CO3 | 洗气 |
| C | 乙醇(水) | 生石灰 | 蒸馏 |
| D | 氧化铁(氧化铝) | NaOH溶液 | 过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| H2CO3 | H2C2O4 | HNO2 | HClO |
| K1=4.4×10-7 K2=4.7×10-11 | K1=5.4×10-2 K2=5.3×10-5 | K=7.2×10-4 | K=2.9×10-8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀盐酸 | B. | FeCl3 | C. | Fe(NO3)3 | D. | BaCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
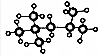 ,其分子式为:C8H18,A的一氯代物有4种;A有多种同分异构体,写出其中一氯代物只有一种同分异构体的结构简式(CH3)3CC(CH3)3;
,其分子式为:C8H18,A的一氯代物有4种;A有多种同分异构体,写出其中一氯代物只有一种同分异构体的结构简式(CH3)3CC(CH3)3;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 2:1 | C. | 3:1 | D. | 4:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
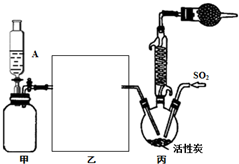 硫酰氯(SO2Cl2)是一种重要的化工试剂,实验室合成硫酰氯的实验装置如图所示:
硫酰氯(SO2Cl2)是一种重要的化工试剂,实验室合成硫酰氯的实验装置如图所示:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com