
分析 (1)依据化学平衡的三段式列式计算物质的平衡浓度,结合平衡常数概念计算得到;
(2)反应前氢气的浓度为:$\frac{1mol}{10L}$0.10mol/L,根据v(H2)=$\frac{△c}{△t}$计算出2分钟内的H2的反应速率.
解答 解:(1)在某温度下,将H2和I2各1mol的气态混合物充入10L的密闭容器中,充分反应,达到平衡后测得c(H2)=0.08mol/L,
H2 +I2 ?2HI
起始量(mol/L) 0.10 0.10 0
变化量(mol/L) 0.02 0.02 0.04
平衡量(mol/L) 0.08 0.08 0.04
则该温度下该反应的平衡常数为:K=$\frac{0.0{4}^{2}}{0.08×0.08}$=0.25;
答:该反应的平衡常数为0.25;
(2)达到平衡后测得c(H2)=0.08mol/L,反应前氢气的浓度为:$\frac{1mol}{10L}$0.10mol/L,则2min内氢气的平均反应速率为:v(H2)=$\frac{0.10mol/L-0.08mol.L}{2min}$=0.01mol/(L•min),
答:2分钟内氢气的平均反应速率为0.01mol/(L•min).
点评 本题考查了化学平衡常数的计算,题目难度中等,明确化学平衡常数、化学反应速率的概念及表达式为解答关键,注意掌握三段式在化学计算中的应用,试题培养了学生的化学计算能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | D | F | H | |||||
| 3 | B | C | E | G |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{a}^{b}$ R | B. | ${\;}_{a-2}^{a+b-2}$ R | C. | ${\;}_{a+2}^{a+b+2}$ R | D. | ${\;}_{a-2}^{a+b}$ R |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有①② | B. | 只有①②③④ | C. | 只有①②③ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1的醋酸加水稀释,$\frac{c({H}^{+})}{c(O{H}^{-})}$减小 | |
| B. | 向水中加入少量固体硫酸氢钠,c(H+)增大,KW变大 | |
| C. | 体积、pH均相同的醋酸和盐酸完全溶解等量的镁粉(少量)后者用时少 | |
| D. | 常温下,V1L pH=11的NaOH溶液与V2L pH=3的HA溶液混合,若混合液显中性,则V1≤V2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | O2中只存在非极性共价键,SO2是共价化合物 | |
| B. | 氧化剂是O2,还原产物只有Fe2O3 | |
| C. | 每消耗22.4LO2,即转移4NA个电子 | |
| D. | SO2溶于水之后的溶液可以导电,所以SO2是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

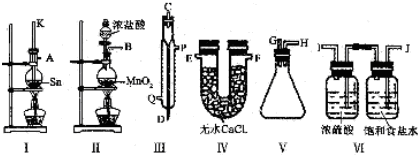
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
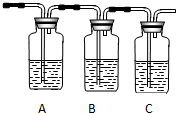 品红溶液 KMnO4 溶液品红溶液 品红溶液 KMnO4 溶液品红溶液 ① |  ② ② | 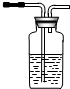 ③ | 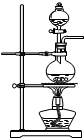 ④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com