
| A. | 标准状况下生成N的体积为$\frac{22.4(n-m)}{51}$L | |
| B. | 沉淀中OH-的质量为17bVg | |
| C. | 恰好溶解后溶液中的NO3-的物质的量为$\frac{bV}{1000}$mol | |
| D. | 与合金反应的硝酸的物质的量为($\frac{n-m}{51}$+$\frac{bV}{1000}$)mol |
分析 mg铝镁合金与一定浓度的稀硝酸恰好完全溶解(假定硝酸的还原产物只有NO),向反应后的混合溶液中滴加b mol/L NaOH溶液,当滴加到V mL时,得到沉淀质量恰好为最大值n克,沉淀质量最大为氢氧化铝和氢氧化镁质量之和,此时溶液为硝酸钠溶液,
A、根据电子守恒原理计算生成NO的物质的量,再根据V=nVm计算NO的体积;
B、沉淀为氢氧化铝和氢氧化镁,沉淀质量等于铝镁合金质量与氢氧根质量之和;
C、恰好溶解后溶液中的NO3-离子的物质的量等于沉淀质量最大溶液中NO3-离子的物质的量,即n(NO3-)=n(Na+)=n(NaOH),据此进行计算;
D、根据质量守恒,硝酸有两种作用,作为酸的硝酸(生成硝酸盐)的物质的量等于硝酸钠的物质的量,作氧化剂的硝酸的物质的量等于NO的物质的量进行计算.
解答 解:A、根据电子守恒原理,生成NO时,HNO3中+5价的N原子得3个电子,因此生成NO的物质的量应该是转移电子的三分之一,即$\frac{n-m}{17}$mol×$\frac{1}{3}$=$\frac{n-m}{51}$mol,其体积在标准状况下为$\frac{22.4(n-m)}{51}$L,故A正确;
B、沉淀为氢氧化铝和氢氧化镁,沉淀质量等于铝镁合金质量与氢氧根质量之和,所以沉淀中氢氧根的质量为(n-m)克,故B错误;
C、恰好溶解后溶液中的NO3-离子的物质的量等于沉淀质量最大溶液中NO3-离子的物质的量,当沉淀量最大时,溶液中的溶质只有硝酸钠(NaNO3),硝酸根离子与钠离子的物质的量相等,n(NO3-)=n(Na+)=n(NaOH)=$\frac{bV}{1000}$mol,故C正确;
D、参加反应的硝酸有两种作用,起酸和氧化剂作用,作为酸的硝酸(生成硝酸盐)的物质的量等于硝酸钠的物质的量为$\frac{bV}{1000}$mol,作氧化剂的硝酸的物质的量等于NO的物质的量为$\frac{n-m}{51}$mol,所以与合金反应的硝酸的物质的量为($\frac{n-m}{51}$+$\frac{bV}{1000}$)mol,故D正确.
故选:B.
点评 本题结合铝镁与硝酸反应及生成的盐与氢氧化钠反应的特点,对电子守恒、溶液电中性原理、质量守恒进行综合考查,难度中等,题目以多项形式呈现,考查了学生的综合运用知识能力和解决复杂问题的能力,是一道考查能力的好题.


科目:高中化学 来源: 题型:选择题
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 研究人员发现了一种“水’’电池,其总反应为:5Mn02+2Ag+2NaCl=Na2Mn5O10+2AgCl.如图用“水”电池为电源电解NaCl溶液的实验中,X电极上有无色气体逸出.下列有关分析正确的是( )
研究人员发现了一种“水’’电池,其总反应为:5Mn02+2Ag+2NaCl=Na2Mn5O10+2AgCl.如图用“水”电池为电源电解NaCl溶液的实验中,X电极上有无色气体逸出.下列有关分析正确的是( )| A. | I为负极,其电极反应式为Ag+Cl--e-=AgCl | |
| B. | “水”电池内Na+不断向负极作定向移动 | |
| C. | 每转移1mole-,U型管中消耗0.5mol H2O | |
| D. | 开始时U型管中Y极附近pH逐渐增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
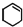 )为原料合成,路线如下(部分反应条件省略):
)为原料合成,路线如下(部分反应条件省略):
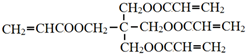
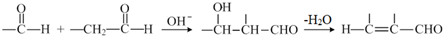

 的化学方程式是
的化学方程式是 .
.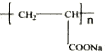
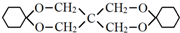 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 福尔马林可作食品的保鲜剂 | |
| B. | 聚乙烯塑料制品可作食品的包装材料 | |
| C. | 碳酸氢钠可于治疗胃酸过多症 | |
| D. | 食盐可作调味剂,也可作食品防腐剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 绿色化学的核心就是治理工业生产对环境产生的污染 | |
| B. | 铁、钙、碘都是人体必不可少的微量元素 | |
| C. | 食盐可作调味剂,但不可作食品防腐剂 | |
| D. | “地沟油”经过加工处理后,可以用来制肥皂和生物柴油 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com