
| A. | SO2,SiO2,P2O5 | B. | PCl3,CO2,H2SO4 | C. | SiC,H2O,NH3 | D. | HF,CO2,Si |
 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 产物不同 | B. | 都属于取代反应 | ||
| C. | 碳氢键断裂的位置相同 | D. | 碳氢键断裂的位置不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Cu2+、Cl-、SO42- | B. | AlO2-、K+、CO32-、Na+ | ||
| C. | Cl-、Al3+、NH4+、HCO3- | D. | Na+、Ca2+、Cl-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 烃A是一种重要的化工原料.己知A在标准状况下的密度为1.16g•L-1,B可发生银镜反应.它们之间的转化关系如图:请回答:
烃A是一种重要的化工原料.己知A在标准状况下的密度为1.16g•L-1,B可发生银镜反应.它们之间的转化关系如图:请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、K+、OH-、Cl- | B. | Na+、Cu2+、SO42-、NO3- | ||
| C. | Mg2+、Na+、SO42-、Cl- | D. | Ca2+、HCO3-、NO3-、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸和乙醇酯化时,采用沸水浴加热 | |
| B. | 可用先加NaOH再分液方法,除去乙醇中的乙酸乙酯 | |
| C. | 可通过灼烧再闻气味的方法,区分蚕丝和羊毛 | |
| D. | 可通过分馏煤焦油,得到苯、二甲苯等有机原料 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
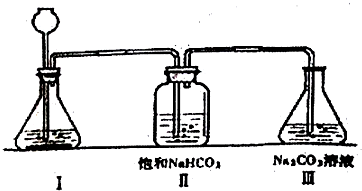
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
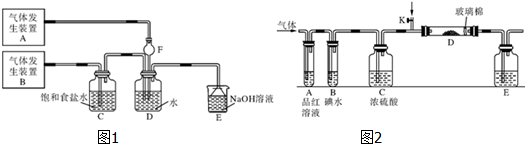
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 取该溶液1 mL稀释至100 mL后,pH约等于3 | |
| B. | 向该溶液中加入pH为13的氢氧化钡溶液恰好完全中和 | |
| C. | 该溶液中硝酸电离出的c(H+)与水电离出的c(H+)之比值为10-12 | |
| D. | 该溶液中水电离出的c(H+)是pH为3的硝酸中水电离出的c(H+)的100倍 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com