
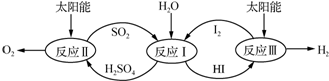
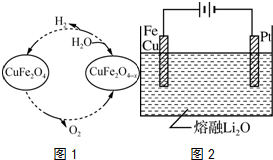
分析 (1)将方程式③-2①得方程式②,焓变进行相应的改变;化学平衡常数K等于生成物浓度幂之积与反应物浓度幂之积的比;
(2)①硫酸和氯化钡反应生成硫酸钡白色沉淀,HI和氯化钡不反应;
②A.SO2在反应Ⅰ化合价由+4价变为+6价,失电子化合价升高的反应物是还原剂;
B.H2SO4溶液和HI溶液互溶;
C.分成两层,与溶解性、密度有关;
D.I2在HI溶液中比在H2SO4溶液中易溶,则碘在不同溶剂中溶解性不同,类似萃取;
(3)①CuFe2O4-x与水反应生成氢气和CuFe2O4;
②根据方程式计算生成氢气体积;
③阳极上Fe、Cu失电子和氧离子反应生成CuFe2O4.
解答 解:(1)将方程式③-2①得方程式②2SO3(g)═2SO2(g)+O2(g)△H=a kJ•mol-1=(+550.2kJ•mol-1
)-2(+177.3kJ•mol-1)=195.6kJ/mol;化学平衡常数K等于生成物浓度幂之积与反应物浓度幂之积的比,则K=$\frac{{c}^{2}(S{O}_{2}).c({O}_{2})}{{c}^{2}(S{O}_{3})}$;
故答案为:195.6;K=$\frac{{c}^{2}(S{O}_{2}).c({O}_{2})}{{c}^{2}(S{O}_{3})}$;
(2)①硫酸和氯化钡反应生成硫酸钡白色沉淀,HI和氯化钡不反应,所以可以用BaCl2鉴别,
故答案为:BaCl2;
②A.SO2在反应Ⅰ化合价由+4价变为+6价,失电子化合价升高的反应物是还原剂,二氧化硫作还原剂,故A错误;
B.H2SO4溶液和HI溶液都是无机物溶液,根据相似相溶原理知,二者互溶,故B错误;
C.两层溶液的密度存在差,才出现上下层,故C正确;
D.I2在HI溶液中比在H2SO4溶液中易溶,则碘在不同溶剂中溶解性不同,类似萃取,所以分层,故D正确;
故选CD;
(3)①CuFe2O4-x与水反应生成氢气和CuFe2O4,反应方程式为CuFe2O4-x+xH2O═CuFe2O4+xH2↑,
故答案为:CuFe2O4-x+xH2O═CuFe2O4+xH2↑;
②根据方程式CuFe2O4-x+xH2O═CuFe2O4+xH2↑知,如果x=0.15,生成1molCuFe2O4的同时生成0.3mol氢气,氢气体积=0.3mol×22.4L/mol=3.36L,
故答案为:3.36;
③阳极上Fe、Cu失电子和氧离子反应生成CuFe2O4,阳极反应式为Cu+2Fe+4O2--8e-═CuFe2O4,
故答案为:Cu+2Fe+4O2--8e-═CuFe2O4.
点评 本题考查化学平衡计算、物质鉴别、氧化还原反应、电解原理等知识点,侧重考查学生分析判断及计算能力,明确化学反应原理、元素化合物性质是解本题关键,难点是电极反应式的书写,注意:活泼金属作阳极时阳极上金属失电子而不是电解质中阴离子失电子,为易错点.


科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AlCl3═Al3++Cl- | B. | Ca(OH)2═Ca2++(OH)2- | ||
| C. | Mg(NO3)2═Mg2++2NO3- | D. | Na2SO4═Na2++SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知2C(s)+O2(g)═2CO(g)△H=-221 kJ•mol-1,则C(碳)的燃烧热为110.5 kJ•mol-1 | |
| B. | 已知氢气燃烧热△H=-285.5 kJ•mol-1,则2H2O(l)=2H2(g)+O2(g)△H=+285.5 kJ•mol-1 | |
| C. | 已知中和热△H=-57.3 kJ•mol-1,若将含0.5 mol H2SO4的稀溶液与1 mol NaOH固体混合,放出的热量小于57.3 kJ | |
| D. | 含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出热量28.7 kJ,则稀醋酸和稀NaOH溶液反应的热化学方程式为:NaOH(aq)+CH3COOH(aq)═CH3COONa(aq)+H2O(l)△H>-57.4 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在25℃的蒸馏水中,FeS的溶解度最大 | |
| B. | 25℃时,CuS的饱和溶液中Cu2+的浓度约为1.14×10-18 mol•L-1 | |
| C. | 可用FeS固体作沉淀剂除去废水中的Cu2+ | |
| D. | 向物质的量浓度相同的FeCl2、ZnCl2混合液中加入少量Na2S,只有FeS沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学式 | AgCl | Ag2CrO4 | CH3COOH | HC1O | H2CO3 |
| KSp 或Ka | Ksp=1.8×10-10 | Ksp=2.0×10-12 | Ka=1.8×10 -5 | Ka=3.0×10-8 | Ka1=4.1×10一7 Ka2=5.6×10-11 |
| A. | 相同浓度CH3COONa和Na2CO3的混合液中,各离子浓度的关系有:c(Na+)>c(CO32- )>c(CH3COO- ) | |
| B. | 向0.1 mol•L-1 CH3COOH溶液中滴加NaOH溶液至溶液pH=5,此时 c(CH3COOH):c(CH3COO-)=9:5 | |
| C. | 少量碳酸氢钠固体加入到新制的氯水中,c(HC1O)增大 | |
| D. | 向浓度均为1×10-3 mol•L-1的KC1和K2CrO4混合液中滴加1×10-3 mol•L-1 的AgNO3溶液,CrO42-先形成沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知甲烷的燃烧热为890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)=2CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| B. | 已知C(石墨,s)=C(金刚石,s)△H>0,则金刚石比石墨稳定 | |
| C. | 已知中和热为△H=-57.4 kJ•mol-1,则1mol稀硫酸和足量稀NaOH溶液反应的反应热就是中和热 | |
| D. | CO(g)的燃烧热是283.0 kJ•mol-1,则2CO2(g)═2CO(g)+O2(g)反应的△H=+(2×283.0)kJ•mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com