
| A.延长反应时间 | B.充入过量H2 |
| C.充入过量N2 | D.升高温度 |
科目:高中化学 来源:不详 题型:单选题
| A.化学物质发生反应放热或吸热由反应物和生成物的总能量决定 |
| B.可通过将煤粉碎等措施提高煤燃烧效率 |
| C.核能利用有可能造成辐射危害,故应限制其发展 |
| D.煤的气化和液化是高效、清洁地利用煤炭的重要途径 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.太阳能 | B.石油 | C.天然气 | D.酒精 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.煤、石油和天然气都属于碳素燃料 |
| B.发展太阳能经济有助于减缓温室效应 |
| C.太阳能电池可将太阳能转化为电能 |
| D.目前研究菠菜蛋白质“发电”不属于太阳能文明 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:多选题
| 催化剂 |
| A.不同的催化剂对化学反应速率影响均相同 |
| B.新法合成氨与哈伯法相比不需要在高温条件下,可节约大量能源,极具发展前景 |
| C.新法合成氨能在常温下进行是因为不需要断裂化学键 |
| D.哈伯法合成氨与新法合成氨都是放热反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.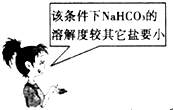 | B.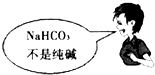 |
C. | D.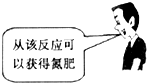 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.将氮气、氢气合成氨,必须施加高温、高压、催化剂等反应条件 |
| B.在氮气、氢气合成氨的化学反应中,催化剂的性能对反应物的温度和压强的高低具有一定的制约作用 |
| C.现代工业上实施的合成氨属于仿生固氮 |
| D.将NH3转化为固态化肥NH4Cl也属于人工固氮 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
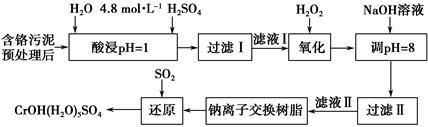
| 阳离子 | Fe3+ | Mg2+ | Al3+ | Cr3+ |
| 开始沉淀时的pH | 2.7 | - | - | - |
| 沉淀完全时的pH | 3.7 | 11.1 | 8 | 9(>9溶解) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com