

分析 (1)Na2S水解呈碱性,且有两步水解,以第一步水解为主;
(2)当两种沉淀共存时,Ag+离子浓度相同,根据$\frac{Ksp(AgBr)}{Ksp(AgCl)}$=$\frac{c(Ag{\;}^{+})•c(B{r}^{-})}{c(Ag{\;}^{+})•c(C{l}^{-})}$,结合$\frac{c(B{r}^{-})}{c(C{l}^{-})}$和Ksp(AgCl)的值可计算出Ksp(AgBr)的值;
(3)利用盖斯定律,将②-①再除以2可得反应2CO(g)$\stackrel{高温}{?}$C(s)+CO2(g),据此计算反应热;
解答 解:(1)Na2S水解呈碱性,且有两步水解,以第一步水解为主,第一步水解生成离子HS-,第二步水解生成H2S,水解的离子方程式分别为S2-+H2O?HS-+OH-;
HS-+H2O?H2S+OH-,
故答案为:S2-+H2O?HS-+OH-\HS-+H2O?H2S+OH-;
(2)当两种沉淀共存时,Ag+离子浓度相同,根据$\frac{Ksp(AgBr)}{Ksp(AgCl)}$=$\frac{c(Ag{\;}^{+})•c(B{r}^{-})}{c(Ag{\;}^{+})•c(C{l}^{-})}$,有Ksp(AgBr)=$\frac{c(B{r}^{-})}{c(C{l}^{-})}$×Ksp(AgCl)=2.7×10-3×2.0×10-10=5.4×10-13,
故答案为:5.4×10-13;
(3)根据反应BaSO4(s)+4C(s)$\frac{\underline{\;高温\;}}{\;}$4CO(g)+BaS(s)△H1=571.2kJ•mol-1 ①
BaSO4(s)+2C(s)$\frac{\underline{\;高温\;}}{\;}$2CO2(g)+BaS(s)△H2=226.2kJ•mol-1 ②
利用盖斯定律,将②-①再除以2可得反应2CO(g)$\stackrel{高温}{?}$C(s)+CO2(g)△H=$\frac{226.2kJ•mol{\;}^{-1}-571.2kJ•mol{\;}^{-1}}{2}$=-172.5kJ•mol-1,
故答案为:-172.5.
点评 本题考查较为综合,题目具有一定难度,涉及盐类的水解、难溶电解质的溶解平衡、反应热的计算等问题,本题注意溶度积常数的利用.


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
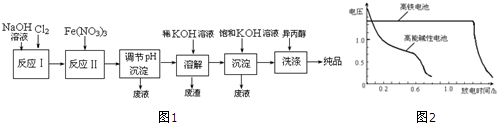
| 湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 物质 | 熔点/℃ | 沸点/℃ |
| 1-丁醇 | -89.5 | 117.3 |
| 1-溴丁烷 | -112.4 | 101.6 |
| 丁醚 | -95.3 | 142.4 |
| 1-丁烯 | -185.3 | -6.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知下列数据:
已知下列数据:| 物质 | 熔点(℃) | 沸点(℃) | 密度(g•cm-3) |
| 乙醇 | -117.0 | 78.0 | 0.79 |
| 乙酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.90 |
| 实验 | 乙醇(mL) | 乙酸(mL) | 乙酸乙酯(mL) |
| ① | 2 | 2 | 1.33 |
| ② | 3 | 2 | 1.57 |
| ③ | 4 | 2 | x |
| ④ | 5 | 2 | 1.76 |
| ⑤ | 2 | 3 | 1.55 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 开始沉淀的pH | 沉淀完全的pH | |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Zn2+ | 5.9 | 8.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | S>I2>Fe3+>Cl2 | B. | Cl2>Fe3+>I2>S | C. | Fe3+>Cl2>S>I2 | D. | Cl2>I2>Fe3+>S |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol FeCl3跟水完全反应转化为氢氧化铁胶体后,其中胶体粒子的数目为NA | |
| B. | 由2H和18O所组成的水11 g,其中所含的中子数为4NA | |
| C. | 常温下丁烯和环丙烷组成的42 g混合气体中H原子数为6NA | |
| D. | 1 mol FeI2与足量氯气反应时转移的电子数为2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com