
| ① | He-268.8 | (a)-249.5 | Ar-185.8 | Kr 151.7 |
| ② | F2-187.0 | Cl2-33.6 | (b) 58.7 | I2 184.0 |
| ③ | (c) 19.4 | HCl-84.0 | HBr-67.0 | HI-35.3 |
| ④ | H2O 100.0 | H2S-60.0 | (d)-42.0 | H2Te-1.8 |
| ⑤ | CH4-161.0 | SiH4-112.0 | GeH4-90.0 | (e)-52.0 |
| A、a、b、c代表的化学物质中均含化学键 |
| B、系列②物质均有氧化性;系列③物质对应水溶液均是强酸 |
| C、系列④中各化合物的稳定性顺序为H2O>H2S>H2Se>H2Te |
| D、上表内物质HF和H2O,由于氢键的影响,其分子特别稳定 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| 阳离子 | K+、Ag+、Mg2+ |
| 阴离子 | NO3-、CO32-、SiO32-、SO42- |
| 序号 | 实验内容 | 实验结果 |
| Ⅰ | 向该溶液中加入足量稀HCl | 产生白色沉淀并放出0.56L气体 |
| Ⅱ | 将Ⅰ的反应混合液过滤,对沉淀洗涤、灼烧至恒重,称量所得固体质量 | 固体质量为2.4g |
| Ⅲ | 在Ⅱ的滤液中滴加BaCl2溶液 | 无明显现象 |
| 阴离子 | NO3- | CO32- | SiO32- | SO42- |
| c/mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
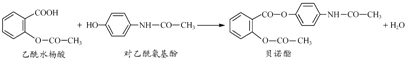
| A、贝诺酯分子式为C17H15NO5 |
| B、可用浓溴水区别乙酰水杨酸和对乙酰氨基酚 |
| C、乙酰水杨酸和对乙酰氨基酚均能与NaHCO3溶液反应 |
| D、1 mol贝诺酯与足量NaOH溶液反应,最多消耗4 mol NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Al(OH)3与氨水反应Al(OH)3+NH3?H2O═AlO2-+NH4++2H2O |
| B、铁跟三氯化铁溶液反应 Fe+2Fe3+═3Fe2+ |
| C、铝片浸入硝酸汞溶液 2Al+3Hg2+═2Al3++3Hg |
| D、明矾溶于水 Al3++3H2O═Al(OH)3+3H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K+、H+、SiO32-、SO42- |
| B、Na+、K+、OH-、SiO32- |
| C、Fe2+、Cl-、OH-、HCO3- |
| D、Na+、H+、AlO2-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氧化剂是H3AsO3,SnCl62-是氧化产物 |
| B、还原性:Cl->As |
| C、每生成1 mol As,反应中转移电子的物质的量为6 mol |
| D、M为OH- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com